Hỗn hợp A gồm 2 oxit là Fe2O3 và CuO, trong đó số mol CuO gấp 3 lần số mol Fe2O3.
Tính % khối lượng mỗi oxit trong hỗn hợp A.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt nFe2O3 = x (mol) ⇒ nCuO = \(\dfrac{1}{2}\)x
1. PTHH:
CuO + H2SO4 → CuSO4 + H2O (1)
1 mol : 1mol : 1 mol : 1 mol
\(\dfrac{1}{2}\)x : \(\dfrac{1}{2}\)x : \(\dfrac{1}{2}\)x : \(\dfrac{1}{2}\)x
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O (2)
1 mol : 3 mol : 1 mol : 3 mol
x mol : x mol : x mol : x mol
nH2SO4 = \(\dfrac{68,6}{98}\)= 0,7 (mol)
Theo (1) và (2): nH2SO4 = \(\dfrac{1}{2}\)x + 3x = 0,7 ⇒ x = 0,2 (mol)
⇒ nCuO = \(\dfrac{1}{2}\)x = \(\dfrac{1}{2}\).0,2 = 0,1 (mol)
2. mCuO = n.M = 0,1.80 = 8 (g)
mFe2O3 = n.M = 0,2.160 = 32 (g)
mhh A = mCuO + mFe2O3 = 8 + 32 = 40 (g)
% khối lượng mỗi oxit trong hỗn hợp A lần lượt là:
%mCuO = \(\dfrac{m_{CuO}}{m_{hhA}}\).100% = \(\dfrac{8}{40}\).100% = 20%
%mFe2O3 = 100% - 20% = 80%

a,\(n_{HCl}=0,5.1=0,5\left(mol\right)\)
PTHH: CuO + 2HCl → CuCl2 + H2O
Mol: x 2x
PTHH: Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Mol: y 6y
Ta có: \(\left\{{}\begin{matrix}80x+160y=16\\2x+6y=0,5\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,05\end{matrix}\right.\)
PTHH: CuO + 2HCl → CuCl2 + H2O
Mol: 0,1 0,2
PTHH: Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Mol: 0,05 0,3
\(\Rightarrow m_{CuO}=0,1.80=8\left(g\right);m_{Fe_2O_3}=16-8=8\left(g\right)\)
b,\(\%m_{CuO}=\dfrac{8.100\%}{16}=50\%;\%m_{Fe_2O_3}=100-50=50\%\)

\(n_{HCl}=0,5.1=0,5\left(mol\right)\)
a)
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
x------->2x
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
y--------->6y
Có hệ: \(\left\{{}\begin{matrix}2x+6y=0,5\\80x+160y=16\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,05\end{matrix}\right.\)
\(m_{CuO}=0,1.80=8\left(g\right)\\ m_{Fe_2O_3}=0,05.160=8\left(g\right)\)
b
\(\%m_{CuO}=\dfrac{0,1.80.100\%}{16}=50\%\\ \%m_{Fe_2O_3}=\dfrac{0,05.160.100\%}{16}=50\%\)

\(n_{CuO}=2a\left(mol\right)\Rightarrow n_{Fe_2O_3}=a\left(mol\right)\)
\(m_X=80\cdot2a+160a=80\left(g\right)\)
\(\Rightarrow a=0.25\left(mol\right)\)
\(CuO+H_2\underrightarrow{^{^{t^0}}}Cu+H_2O\)
\(Fe_2O_3+3H_2\underrightarrow{^{^{t^0}}}2Fe+3H_2O\)
\(n_{H_2}=0.5+0.25\cdot3=1.25\left(mol\right)\)
\(V_{H_2}=1.25\cdot22.4=28\left(l\right)\)
\(m_{cr}=0.5\cdot64+0.5\cdot56=60\left(g\right)\)

PTHH: \(CuO+2HCl\rightarrow CuCl_2+H_2O\)
a______2a (mol)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
b______6b (mol)
Ta có: \(\left\{{}\begin{matrix}80a+160b=24\\2a+6b=0,8\cdot1=0,8\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{0,1\cdot80}{24}\cdot100\%\approx33,33\%\\\%m_{Fe_2O_3}=66,67\%\end{matrix}\right.\)
a) Pt : CuO + 2HCl → CuCl2 + H2O\(|\)
1 2 1 1
a 2a
Fe2O3 + 6HCl → 2FeCl3 + 3H2O\(|\)
1 6 2 3
b 6b
b) Gọi a là số mol của CuO
b là số mol của Fe2O3
Theo đề ta có : mCuO + MFe2O3 = 24 (g)
⇒ nCuO . MCuO + nFe2O3 . MFe2O3 = 24 g
80a + 160b = 24 g (1)
800ml = 0,8l
Số mol của dung dịch axit clohiric
CMHCl = \(\dfrac{n}{V}\Rightarrow n=C_M.V=1.0,8=0,8\left(mol\right)\)
⇒ 2a + 6b = 0,8 (2)
Từ (1),(2), ta có hệ phương trình :
80a + 160b = 24
2a + 6b = 0,8
⇒ \(\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
Khối lượng đồng (II) oxit
mCuO = nCuO . MCuO
= 0,1. 80
= 8 (g)
Khối lượng của sắt (III) oxit
mFe2O3 = nFe2O3 . MFe2O3
= 0,1. 160
= 16 (g)
0/0CuO = \(\dfrac{m_{CuO}.100}{m_{hh}}=\dfrac{8.100}{24}=33,3\)30/0
0/0Fe2O3= \(\dfrac{m_{Fe2O3}.100}{m_{hh}}=\dfrac{16.100}{24}=66,67\)0/0
Chúc bạn học tốt

Đáp án B
CuO + 2HCl → CuCl2 + H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Giả sử số mol 2 muối CuCl2 và FeCl3 đều là 1 mol
=> nCuO = nCuCl2 = 1 mol ; nFe2O3 = 0,5nFeCl3 = 0,5 mol
=> mhh đầu = 80.1 + 160.0,5 = 160g
=> %mCuO = %mFe2O3 = 50%
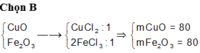
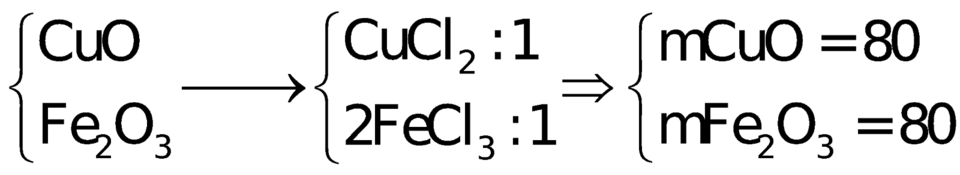

Gọi \(n_{Fe_2O_3}=a\left(mol\right)\Rightarrow n_{CuO}=3a\left(mol\right)\)
Ta có: \(m_{hh}=160a+80.3a=400a\left(g\right)\)
\(\%m_{Fe_2O_3}=\dfrac{160a.100\%}{400a}=40\%\)
\(\%m_{CuO}=100-40=60\%\)