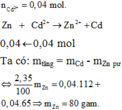ngâm một lá kẽm trong 200 gam dung dịch CuSO4 16% phản ứng xong thấy khối lượng lá Zn giảm 0,5% khối lượng lá Zn trước khi tham gia phản ứng là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



mAgNO3=5,1g
=> nAgNO3=0,03mol
PTHH: Zn+ 2AgNO3=>Zn(NO3)2+2Ag
0,06 <-0,03 ->0,03 ->0,06
mZn đã dùng:m=0,06.65=3,9g

Gọi x là số mol của Zn ta có
\(Zn+CuSO_4\rightarrow ZnSO_4+Cu\)
65x 64x
\(65x-64x=0.2\)
\(x=0.2\left(mol\right)\)
\(m_{Zn}=n\times M=0.2\times65=13\left(g\right)\)
Vậy khối lượng Zn phản ứng là 13(g)

\(n_{Zn\left(pứ\right)}=1,3-0,65=0,65g\)
\(n_{Zn}=\dfrac{0,65}{65}=0,01mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,01 0,02 0,01 0,01 ( mol )
\(V_{H_2}=0,01.24=0,24l\)
\(m_{HCl}=\dfrac{0,02.36,5}{7,3\%}=10g\)
\(m_{ZnCl_2}=0,01.136=1,36g\)
\(m_{ddspứ}=1,3+10-0,01.2=11,28g\)
\(C\%_{ZnCl_2}=\dfrac{1,36}{11,28}.100=12,05\%\)