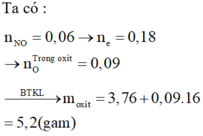Hoà tan 6,12g kim loại M trong dung dịch HNO3 2M loãng (lấy dư 20% so với lượng phản ứng) thu được hai sản phẩm khử gồm 0,04 mol N2 và 0,035 mol N2O.
a) Xác định kim loại M.
b) Tính thể tích dung dịch HNO3 ban đầu.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án D
Fe tác dụng với khí C l 2 thì luôn lên F e 3 +
Fe hay hỗn hợp các oxit sắt tác dụng với H N O 3 (loãng dư) đều thu được ion F e 3 +
+ Với 1-2 cho muối F e 3 +
+ Các trường hợp còn lại cho F e 2 + hoặc hỗn hợp muối F e 2 + và F e 3 +

a, Ta có: \(n_{NO}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\)
Theo ĐLBT e, có: 2nR = 0,02.3 ⇒ nR = 0,03 (mol)
\(\Rightarrow M_R=\dfrac{1,92}{0,03}=64\left(g/mol\right)\)
Vậy: R là Cu.
b, Ta có: nHNO3 (pư) = 4nNO = 0,08 (mol)
Mà: HNO3 dùng dư 10% so với lượng cần pư.
⇒ nHNO3 = 0,08 + 0,08.10% = 0,088 (mol)
\(\Rightarrow C_{M_{HNO_3}}=\dfrac{0,088}{0,1}=0,88\left(M\right)\)

Gọi n, m là hóa trị của R khi tác dụng HNO3 và H2SO4 loãng ( 1≤ m≤ n≤ 3)
Chọn nR= 1 mol
2R + mH2SO4 →R2(SO4)m + mH2↑
1 → 0,5 0,5m
R + 2nHNO3 →R(NO3)n + nNO2 + nH2O
1 1 n
Ta có: n=3.0,5m n=1,5m m=2, n=3 là phù hợp.
Ta có: (R + 96)=(R + 186). 0,6281 R=56 R là Fe.
Đáp án B

a)
M + 2HCl → MCl2 + H2
nH2 = \(\dfrac{3,584}{22,4}=\)0,16 mol => nM = 0,16 mol
<=> MM = \(\dfrac{3,84}{0,16}\)= 24 (g/mol) => M là magie (Mg).
b) 8Mg + 20HNO3 → 8Mg(NO3) + 2NO + N2 + 10H2O
Từ tỉ lệ phương trình , gọi số mol N2 là x => nNO = 2x mol
=> V(NO + N2) =3x.22,4 =1,344
<=> x =0,02
=> VN2 = 0,02.22,4 =0,448 lít , VNO= 0,04.22,4 = 0,896 lít

\(10Al+36HNO_3\rightarrow10Al\left(NO_3\right)_3+3N_2+H_2O\)
\(n_{N_2}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
Bảo toàn e :
\(n_{Al}=\dfrac{10\cdot n_{N_2}}{3}=\dfrac{10}{3}\cdot0.3=1\left(mol\right)\)
\(m_{Al}=1\cdot27=27\left(g\right)\)
\(n_{HNO_3}=12n_{N_2}=12\cdot0.3=3.6\left(mol\right)\)
\(C_{M_{HNO_3}}=\dfrac{3.6}{0.1}=36\left(M\right)\)