ngâm 1 bản kẽm vào cốc chứa 200g dd hcl 10% khi lấy bản kẽm ra ,rửa nhẹ,sấy khô cân thấy khối lượng thanh kẽm giảm đi 6,5g so với ban đầu .tính C% của dd hcl sau pư
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


KL HCl ban đầu= 20g.
Khối lượng Zn giảm đi là khối lượng Zn tham gia phản ứng
=>Số mol Zn phản ứng = 0,1 mol
Zn + 2HCl ---> Zn Cl2 + H2
0,1--->0,2--->0,1 (mol)
Khối lượng HCl còn lại = Khối lượng HCl ban đầu - Khối lượng HCl phản ứng
= 20 - 0,2.36,5 = 12,7g
Khối lượng HCl sau phản ứng = KL HCl ban đầu + KL Zn phản ứng - Kl H2 bay ra
= 200 +6,5 - 0,1.2 =206,3 g
Nồng độ HCL phản ứng = 13,5/ 206,5 .100% = 6,16%

Bài 1:
\(m_{HCl}=200.10\%=20g\)
\(\text{Zn+2HCl-->ZnCl2+h2}\)
m giảm=mZn phản ứng=6.5-->nZn phản ứng=0.1
-->nHCl phản ứng=0.1-->mHCl phản ứng=3.65
\(\Rightarrow\text{mHCl dư=20-3.65=16.35}\)
mdd sau phản ứng =200+6,5-0,1.2=206,3
\(\Rightarrow x\%_{HCl}=\frac{16,35}{206,3}=7,93\%\)
Bài 2:
\(\text{mdd cuso4= 56g-->nCuSO4=0.0525}\)
\(\text{Fe+CuSO4-->FeSO4+Cu}\)
a.........a..............a...........a
Ta có :
\(\text{5-56a+64a=5.16-->a=0.02}\)
mdd sau phản ứng m=56-0.16=55.84
\(C\%_{CuSO4_{du}}=\frac{\text{0.0325.160}}{\text{55.84}}\text{=9.3%}\)
\(C\%_{FeSO4}=\frac{\text{0,02.152}}{\text{55,84}}=\text{5.44 }\text{ }\)

mHCl = \(\frac{2.10\%}{100\%}\)= 20 (g)
Khối lượng lá kẽm giảm 6,5 gam chính là khối lượng Zn tham gia phản ứng
\(\rightarrow\)nZn = mZn : MZn = 6,5 : 65 = 0,1 (mol)
PTHH: Zn + 2HCl\(\rightarrow\)ZnCl2 + H2
_______0,1___0,2__0,1_____0,1 (mol)
Theo PTHH: nH2 = nZnCl2 = nZn pư = 0,1(mol)
\(\rightarrow\)mZnCl2 = 0,1.136 = 13,6 (g)
Theo PTHH: nHCl pư = 2nZn = 2.0,1= 0,2 (mol)
\(\rightarrow\)mHCl pư = 0,2.36,5 = 7,3 (g)
\(\rightarrow\) mHCl dư = mHCl bđ - mHCl pư = 20 - 7,3 = 12,7(g)
Dung dịch sau phản ứng thu được gồm ZnCl2: 13,6 (g) và mHCl pư = 12,7 (g)
mdd sau = mZn pư + mdd HCl - mH2
= 6,5 + 200 - 0,1.2
= 206,3 (g)
Nồng độ phần trăm của các chất trong dd sau pư là:
C% ZnCl2 = \(\frac{13,6}{\text{ 206,3}}\).100% = 6,6%
C% HCl dư = \(\frac{7,3}{\text{ 206,3}}\).100% = 3,54%

PTHH: Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
(Gọi số mol của Zn là a => Số mol của Pb là a)
Sau 1 thời gian lấy lá kẽm ra thấy khối lượng tăng 1,42 gam = Khối lượng Pb sinh ra bám vào lá kẽm trừ đi khối lượng Zn phản ứng.
<=> 207a - 65a = 1,42
<=> a = 0,01 (mol)
a) Khối lượng chì bám vào kẽm là: 207a = 2,07(g)
b) Đổi: 500 ml = 0,5 l
Số mol của dung dịch Pb(NO3)2 là: 0,5 . 2 = 1 (mol)
So sánh: 0,01 < 1
=> Dung dịch Pb(NO3)2 dư , tính theo Zn
Số mol của Zn(NO3)2 là: 0,01 . 1 = 0,01 (mol)
Nồng độ mol của dung dịch sau khi lấy lá kẽm ra là:
CM = n / V = 0,01 : 0,5 = 0,02M
( Vì thể tích dung dịch k thay đổi đáng kể nên sau phản ứng và lấy lá kẽm ra thì thể tích dung dịch vẫn là 500 ml)
PTHH: Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
(Gọi số mol của Zn là a => Số mol của Pb là a)
Sau 1 thời gian lấy lá kẽm ra thấy khối lượng tăng 1,42 gam = Khối lượng Pb sinh ra bám vào lá kẽm trừ đi khối lượng Zn phản ứng.
<=> 207a - 65a = 1,42
<=> a = 0,01 (mol)
a) Khối lượng chì bám vào kẽm là: 207a = 2,07(g)
b) Đổi: 500 ml = 0,5 l
Số mol của dung dịch Pb(NO3)2 là: 0,5 . 2 = 1 (mol)
So sánh: 0,01 < 1
=> Dung dịch Pb(NO3)2 dư , tính theo Zn
Số mol của Zn(NO3)2 là: 0,01 . 1 = 0,01 (mol)
Nồng độ mol của dung dịch sau khi lấy lá kẽm ra là:
CM = n / V = 0,01 : 0,5 = 0,02M
( Vì thể tích dung dịch k thay đổi đáng kể nên sau phản ứng và lấy lá kẽm ra thì thể tích dung dịch vẫn là 500 ml)
chúc bạn học tốt và nhớ tích đúng cho mình

tăng giảm khối lượng...có mol FeSO4=2,25/(65-56)=0.25(mol)
=> a=2,5M

gọi muối của kim loại cần tìm là R(NO3)n
PTPU
nZn+ 2R(NO3)n\(\rightarrow\) nZn(NO3)2+ 2R
.............\(\dfrac{0,383}{n}\)..............0,1915................ mol
có: mmuối ban đầu= 180. 20%= 36( g)
mchất rắn giảm= 5. 4%= 0,2( g)
\(\Rightarrow\) mmuối sau pư= 36+ 0,2= 36,2( g)
khối lượng muối sau pư bằng khối lượng Zn(NO3)2 tạo thành
\(\Rightarrow\) nZn(NO3)2= \(\dfrac{36,2}{189}\)= 0,1915( mol)
có: \(\dfrac{0,383}{n}\).( MR+ 62n)= 36
\(\Rightarrow\) \(\dfrac{0,383.MR}{n}\)= 12,254
\(\Rightarrow\) \(\dfrac{MR}{n}\)= \(\dfrac{12,254}{0,383}\)= 32
\(\Rightarrow\) n=1\(\Rightarrow\) MR= 32( loại)
n= 2\(\Rightarrow\) MR= 64( nhận)
n=3\(\Rightarrow\) MR= 96( loại)
vậy kim loại R là đồng (Cu)
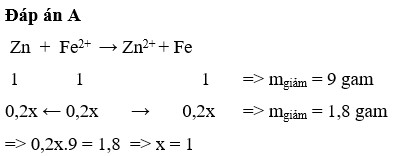
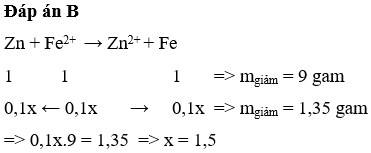
khối lượng HCl ban đầu = 20g.
khối lượng Zn giảm đi là khối lượng Zn tham gia phản ứng
=> số mol Zn phản ứng = 0,1 mol
Zn + 2HCl ------> Zn Cl2 + H2
0,1----->0,2 ----------------->0,1 (mol)
khối lượng HCl còn lại = khối lượng HCl ban đầu - khối lượng HCl phản ứng
= 20 - 0,2.36,5 = 12,7g
khoi luong dung dich HCl sau phan ung = khoi luong dd HCl ban dau + khoi luong Zn phan ung - khoi luong H2 bay ra
= 200 +6,5 - 0,1.2 =206,3 g
Nong do HCl sau phan ung = \(\dfrac{13,5}{206,5}\) .100% = 6,16%
\\tham khảo nhé//
Zn + 2HCl ➞ ZnCl2 + H2
\(m_{HCl}=200\times10\%=20\left(g\right)\)
Khối lượng Zn giảm đi chính là khối lượng Zn tham gia phản ứng
\(\Rightarrow m_{Zn}pư=6,5g\)
\(\Rightarrow n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
Theo PT: \(n_{HCl}pư=2n_{Zn}=2\times0,1=0,2\left(mol\right)\)
\(\Rightarrow m_{HCl}pư=0,2\times36,5=7,3\left(g\right)\)
\(\Rightarrow m_{HCl}dư=20-7,3=12,7\left(g\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,1\left(mol\right)\)
\(\Rightarrow m_{H_2}=0,1\times2=0,2\left(g\right)\)
\(m_{dd}=6,5+200-0,2=206,3\left(g\right)\)
\(C\%_{ddHCl}dư=\dfrac{12,7}{206,3}\times100\%\approx6,16\%\)