Chất X tạo bởi lưu huỳnh và oxi, trong X khối lượng lưu huỳnh = oxi. Xác định hóa trị lưu huỳnh trong X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Công thức hóa học: S x O y
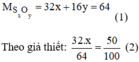
Giải phương trình (2) ta được: x = 1 thay vào pt (1) ⇒ y = 2.
Vậy công thức hóa học của oxit là S O 2

\(CT:S_xO_y\)
\(\%S=\dfrac{32x}{32x+16y}\cdot100\%=40\%\)
\(\Rightarrow32x+16y=80x\)
\(\Rightarrow48x=16y\)
\(\Rightarrow\dfrac{x}{y}=\dfrac{1}{3}\)
\(SO_3\)
Lưu huỳnh hóa trị : VI

\(n_S=\dfrac{6,4}{32}=0,2mol\)
\(n_{O_2}=\dfrac{16}{32}=0,5mol\)
\(S+O_2\underrightarrow{t^o}SO_2\)
0,2 0,5 0,2
Sau phản ứng oxi còn dư và dư \(0,5-0,2=0,3mol\)
Oxit axit được tạo thành là \(SO_2\) và có khối lượng:
\(m_{SO_2}=0,2\cdot64=12,8g\)

a)S+O2-to>SO2
b)Áp dụng định luật baot toàn khói lượngta có:
mSO2=mS+mO2
mSO2=64+64=128(g)
do thất thoát 20%
=>mSO2=128−128.20%=102,4(g)
a,\(S+O_2\rightarrow SO_2\)
b,Ta có:
\(m_{O2}+m_S=m_{SO2}\)
\(\Rightarrow m_{SO2\left(bđ\right)}=128\left(g\right)\)
Do bị thất thoát 20%
\(\Rightarrow m_{SO2}=128:100.80=102,4\left(g\right)\)

a, \(n_S=\dfrac{6,4}{32}=0,2\left(mol\right)\)
PTHH: S + O2 ----to----> SO2
Mol: 0,2 0,2 0,2
b, \(m_{SO_2}=0,2.64=12,8\left(g\right)\)
c, \(V_{O_2}=0,2.22,4=4,48\left(l\right)\)
goi công thức hợp chất X là : S2Ox (với là hóa trị của S,x thuộc N*)
Khối lượng mol lưu huỳnh là :
MS = 32.2 = 64(g/mol)
mà MO=MS =>MO=64(g/mol)
=> 16.x= 64
<=> x= IV
Vậy hóa trị của S trong X là IV(công thức của X là SO2)
hóa trị 4