cho 20g X gồm CuO và Fe2O3 tác dụng hết với 200ml Hcl 3,5M
a tìm thành phần % theo khối lượng 2 oxi trong hh , b tìm nồng độ % của đ thu được c tìm nồng độ % của đ thu đc biết DddHcl là 0,8 g/mlHãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn B
Gọi a là số mol của CuO và b là số mol của F e 2 O 3 có trong 20 gam
hh 200 ml dd HCl 3,5 M => nHCl = 0,2 . 3,5 = 0,7 mol
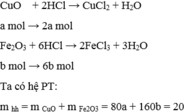
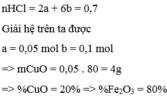

a,
PTHH: CuO + 2HCl → CuCl2 + H2
Mol: x x
PTHH: NaOH + HCl → NaCl + H2O
Mol: y y
Ta có:\(\left\{{}\begin{matrix}80x+40y=10\\135x+58,5y=16,5\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,104\\y=0,042\end{matrix}\right.\)
PTHH: CuO + 2HCl → CuCl2 + H2
Mol: 0,104 0,208
PTHH: NaOH + HCl → NaCl + H2O
Mol: 0,042 0,042
\(\Rightarrow\%m_{CuO}=\dfrac{0,104.80.100}{10}=83,2\%;\%m_{NaOH}=100\%-83,2\%=16,8\%\)
b,\(n_{HCl}=0,208+0,042=0,25\left(mol\right)\)
\(\Rightarrow C_{M_{ddHCl}}=\dfrac{0,25}{0,2}=1,25M\)

\(Fe+2HCl\rightarrow FeCl2+H2\)(1)
1____2________1_______1
\(CuO+2HCl\rightarrow CuCl2+H2O\)(2)
1_______2__________1_____1
Ta có :\(n_{H2}=\frac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_{Fe}=\frac{0,15.1}{1}=0,15\left(mol\right)\)
\(\rightarrow m_{Fe}=0,15.56=8,4g\)
\(\rightarrow m_{CuO}=10-8,4=1,6g\)
b,Theo PT(1)\(n_{HCl}=\frac{0,15.2}{1}=0,3\left(mol\right)\)
\(\rightarrow n_{CuO}=\frac{1,6}{80}=0,02\left(mol\right)\)
Theo PT(2)\(n_{HCl}=\frac{0,02.2}{1}=0,04\left(mol\right)\)
\(\rightarrow\Sigma n_{HCl}=0,3+0,04=0,34\left(mol\right)\)
\(\rightarrow CM_{HCl}=\frac{0,34}{0,2}=1,7M\)

PTHH.Zn+ H2SO4 -> ZnSO4 + H2
Theo bài ra ta có: nZn = 13/65 = 0,2 mol
Theo pthh và bài ta có:
+) nH2SO4 = nZn = 0,2 mol
=> mH2SO4 = 0,2 . 98 = 19,6 g
=> mdd H2SO4 = (19,6 . 100%) : 20% = 98%
+)nH2 = nZn = 0,2 mol
=> VH2 = 0,2 . 22,4 = 4,48 l
Vậy...
2) PTHH: Fe2O3 + 3H2SO4 -> Fe2(SO4)3 + 3H2O
Theo bài ra ta có: nFe2O3 = 24/160 = 0,15 mol
nH2SO4 = 2,5 . 0,2 = 0,5 mol
Theo pthh ta có: nFe2O3 pt = 1 mol ; nH2SO4 pt = 3 mol
Ta có tỉ lệ:
\(\dfrac{nFe2O3\left(bđ\right)}{nFe2O3\left(pt\right)}=\dfrac{0,15}{1}=0,15\)< \(\dfrac{nH2SO4\left(bđ\right)}{nH2SO4\left(pt\right)}=\dfrac{0,5}{3}=0,16\)
=> Sau pư, Fe2O3 tg pư hết , H2SO4 còn dư
Theo pthh và bài ta có:
+nFe2(SO4)3 = nFe2O3 = 0,15 mol
=>mFe2(SO4)3 = 0,15 . 400 = 60 g
CM dd Fe2(SO4)3 = \(\dfrac{0,15}{0,2}=0,75\)(M)
+nH2SO4 tg pư = 3. nFe2O3 = 3. 0,15 = 0,45 mol
=> nH2SO4 dư = 0,5 - 0,45 = 0,05 mol
=> CM dd H2SO4 dư = \(\dfrac{0,05}{0,2}=0,25\left(M\right)\)
Vậy....