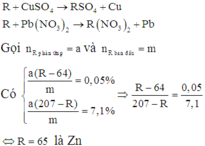Lấy 2 thanh kim loại X, Y có cùng khối lượng và đứng trước Pb trong dãy hoạt động động hóa học. Nhúng thanh X vào dd Cu(NO3)2 và thanh Y vào dd Pb(NO3)2. Sau một thời gian lấy thanh kim loại ra rửa nhẹ, làm khô, cân lại thấy khối lượng thanh X giảm 1% và thanh Y tăng 152% so với khối lượng ban đầu. Biết số mol X, Y tham gia pư bằng nhau; X, Y có hóa trị không đổi trong các hợp chất và tất cả kim loại sinh ra đều bám hết lên X, Y. Mặt khác để hòa tan hoàn toàn 3,9g kim loại X cần dùng V ml dd HCl thu được 1,344 lít khí H2 (đktc), còn để hòa tan hoàn toàn 4,26g oxit của kim loại Y cần dùng V ml dd HCl như trên. Hãy so sánh hóa trị của kim loại X, Y.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A.
Số mol của Cu(NO3)2 và Pb(NO3)2 trong 2 dung dịch giảm như nhau à số mol M phản ứng ở 2 thí nghiệm là như nhau.
Coi khối lượng thanh M là 10 gam.
Gọi số mol M phản ứng là x mol.
Xét thí nghiệm ở thanh 1.
M + Cu(NO3)2 à M(NO3)2 + Cu
x à x
= Mx – 64x = 0,998m = 0,02 (1)
Xét thí nghiệm ở thanh 2.
M + Pb(NO3)2 à M(NO3)2 + Pb
x à x
= 207x – Mx = 2,84 (2)
Từ (1) và (2) ta có: Mx = 1,3; x = 0,02 à M = 65 à M là Zn

Giả sử thanh kim loại ban đầu nặng m (g)
Gọi số mol Cu(NO3)2, Pb(NO3)2 pư là a (mol)
TN1:
PTHH: R + Cu(NO3)2 --> R(NO3)2 + Cu
a<-------a------------------>a
=> mgiảm = a.MR - 64a (g)
Và \(m_{giảm}=\dfrac{0,05m}{100}=0,0005m\left(g\right)\)
=> \(a.M_R-64a=0,0005m\) (1)
TN2:
PTHH: R + Pb(NO3)2 --> R(NO3)2 + Pb
a<-------a------------------->a
=> mtăng = 207a - a.MR (g)
Và \(m_{tăng}=\dfrac{7,1.m}{100}=0,071m\left(g\right)\)
=> \(207a-a.M_R=0,071m\) (2)
(1)(2) => \(\dfrac{M_R-64}{207-M_R}=\dfrac{0,0005}{0,071}\)
=> MR = 65 (g/mol)
=> R là Zn

Câu 1:
2M+nCuSO4\(\rightarrow\)M2(SO4)n+nCu
2M+nFeSO4\(\rightarrow\)M2(SO4)n+nFe
- Gọi a là số mol của M
- Độ tăng khối lượng PTHH1:
64na/2-Ma=20 hay(32n-M).a=20
- Độ tăng khối lượng PTHH2:
56.na/2-Ma=16 hay (28n-M)a=16
Lập tỉ số ta được:\(\dfrac{32n-M}{28n-M}=\dfrac{20}{16}=1,25\)
32n-M=35n-1,25M hay 0,25M=3n hay M=12n
n=1\(\rightarrow\)M=12(loại)
n=2\(\rightarrow\)M=24(Mg)
n=3\(\rightarrow\)M=36(loại)
Câu 2:Gọi A là khối lượng thanh R ban đầu.
R+Cu(NO3)2\(\rightarrow\)R(NO3)2+Cu
R+Pb(NO3)2\(\rightarrow\)R(NO3)2+Pb
- Gọi số mol Cu(NO3)2 và Pb(NO3)2 là x mol
- Độ giảm thanh 1: \(\dfrac{\left(R-64\right)x}{A}.100=0,2\)
- Độ tăng thanh 2: \(\dfrac{\left(207-R\right)x}{A}.100=28,4\)
Lập tỉ số: \(\dfrac{207-R}{R-64}=\dfrac{28,4}{0,2}=142\)
207-R=142R-9088 hay 143R=9295 suy ra R=65(Zn)

gọi x là số mol của R dã pư,theo bài ra ta có pt
R + Cu(NO3)2 = R(NO3)2 + Cu (1)
x x
R + Pb(NO3)2 = R(NO3)2 + Pb (2)
y y
theo (1) thì kim loại R giảm = kim loại R tan ra - kim loại Cu thoát ra bám vào thanh R
hay Rx - 64x = 0,2% * m <=> (R-64)x = 0,2% * m (I)
theo (2) thì kl R tăng = kim loại Pb thoát ra bám vào thanh R - kl R tan ra trong pư.
hay 207x - Rx = 28,4% * m <=> (207 - R)x = 28,4% * m(II)
chia 2 vế của (II)cho (I) ta được:
(207 - R)/(R-64) = 28,4% * m / 0,2% * m = 28,4/0,2 = 142
<=> 207 - R = 142R - 9088
<=> 143R = 9295
<=> R = 65 đvC (Zn)
vậy R là Zn ( kẽm)
Chúc em học tốt !!

\(a.m_X=a\left(g\right);n_{CuSO_4}=n_{Pb\left(NO_3\right)_2}=b\left(mol\right)\\ X+CuSO_4->XSO_4+Cu\\ \Delta m_X=0,05\%\cdot a=b\left(X-64\right)\left(1\right)\\ X+Pb\left(NO_3\right)_2->X\left(NO_3\right)_2+Pb\\ \Delta m_X=7,1\%\cdot a=b\left(207-X\right)\left(2\right)\\ Lấy:\dfrac{\left(1\right)}{\left(2\right)}=\dfrac{0,05\%}{7,1\%}=\dfrac{X-64}{207-X}\\ X=65\left(Zn\right)\\ b.Theo\left(1\right),với:a=15\\ \left(1\right)\Rightarrow0,05\%.15=b\left(65-64\right)\\ b=0,0075mol\\ m_{CuSO_4}=0,0075.160=1,2g\\ m_{Pb\left(NO_3\right)_2}=331.0,0075=2,4825g\)