Cho 0,2 mol Fe vào dd hỗn hợp chứa 0,2 mol Fe(NO3)3 và 0,2 mol AgNO3. Khi pư hoàn toàn, số mol Fe(NO3)3 trong dd bằng ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


(3) Đốt nóng hỗn hợp Fe và S (trong chân không).
(4) Cho kim loại Fe vào lượng dư dung dịch HCl.
(5) Cho Fe vào dung dịch chứa Fe(NO3)3
ĐÁP ÁN C

Đáp án : D
nMg = 0,1 ; nFe = 0,19 mol
Thứ tự phản ứng :
Mg + 2Ag+ -> Mg2+ + 2Ag
Fe + 2Ag+ -> Fe2+ + 2Ag
Fe + Cu2+ -> Fe + Cu
=> Kết tủa gồm : Ag : 0,3 mol ; Cu : 0,14 mol
=> m = 41,36g

Chọn đáp án D
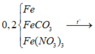
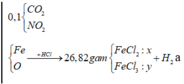
Vì CaCO3 → CO2 + O và NO3 → NO2 + O => nO trong Y = nKhí = 0,1 và nFe trong Y = nX = 0,2
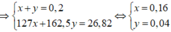
=> nHCl phản ứng = 2x + 3y = 0,44
BTNT.O => nH2O sinh ra = nO trong Y = 0,1
BTNT.H => nH2 = 0,44/2 - 0,1 = 0,12.

Đáp án B
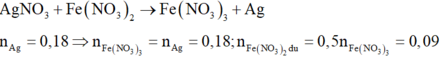
Gọi số mol Al và Mg tối đa mà dung dịch X có thể phản ứng được là x và 3x
Nên 3x + 2.3x = 0,09.2 + 0,18.3(ne cho =ne nhận)
Suy ra x = 0,08 => mAl + mMg = 7,92(g)


Khi cho Fe vào dd hỗn hợp trên thì thứ tự p/ư (có thể xảy ra)
Fe+ 2AgNO3----->Fe(NO3)2+ 2Ag↓(1)
Fe+ 2Fe(NO3)3 ------> 3Fe(NO3)2 (2)
Fe(NO3)2+ AgNO3------>Fe(NO3)3+ Ag↓(3)
Có 2 TH xảy ra
+TH1: Xảy ra (1) và (2) nếu Fe dư (AgNO3 hết)
+TH2: Xảy ra (1) và (3) nếu Fe hết (AgNO3 dư)
Xét tỉ lệ (1) nFe/1> nAgNo3/2 => Fe dư
Vậy xảy ra TH1
Theo PTHH(1) nFe(p.ư)=nFe(NO3)2=1/2nAgNO3=0.1 mol
=>nFe dư=0.2-0.1=0.1 mol
Xét tỉ lệ (2) nFe/1=nFe(NO3)3/2=> p/ư vừa đủ => Fe(NO3)3 hết