Nguyên tử Au có bán kính và khối lượng mol nguyên tử lần lượt là 1,44 Ao và 197 g/mol. Biết khối lượng riêng của Au là 19,36g /cm3. Hỏi các nguyên tử Au chiếm bao nhiêu phần trăm trong tinh thể?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Khối lượng riêng của nguyên tử là:
D = 19,36.100/74 = 26,16(g/ cm 3 )
Khối lượng của 1 mol nguyên tử :
M = V.D.N = 4/3π r 3 .D.N = 4/3. 3,14. 1 , 44 . 10 - 8 3 .26,16. 6,022. 10 23 ≈ 197 (g/mol)

Theo bài ra thể tích của 1 mol Au là \(\frac{197}{19,36}\left(g/cm^3\right)\)
Đặt x % là thể tích các nguyên tử Au trong tinh thể, thì thể tích thực của một nguyên tử Au:
\(V=\frac{197}{19,36}\times\frac{x}{100\times6,02\times10^{23}}\)
Mặt khác với bán kính nguyên tử Au là 1,44 x 10−8 cm ta có:
\(V=\frac{4}{3}\times3,14\times\left(1,44\times10^{-8}\right)^3cm^3\)
⇒ x = 73,95%
Tham khảo nha !

hể tích của 1 phân tử Fe
V(Fe) = 4π/3. r˄3 = 4π/3 . (1,28.10˄-8)˄3 = 8,78.10˄-24 cm˄3
Thể tích của 1 mol Fe:
V = V(Fe).Na/74% = 8,78.10˄-24.6,022.10˄23/0,74 = 7,15cm˄3
Khối lượng riêng của Fe:
d = 56/7,15 = 7,83g/cm˄3



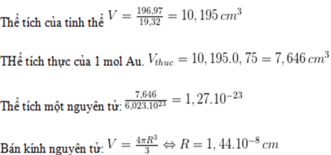
 bài giải đây nha!
bài giải đây nha!
Theo bài ra thể tích của 1 mol Au là \(\dfrac{197}{19,36}\) (g/cm3).
Đặt x % là thể tích các nguyên tử Au trong tinh thể, thì thể tích thực của một nguyên tử Au:
V=\(\dfrac{197}{19,36}\)×\(\dfrac{x}{100.6,02.10^{23}}\)
Mặt khác với bán kính nguyên tử Au là 1,44 x 10−8 cm ta có:
V=\(\dfrac{4}{3}.3,14.\left(1,44.10^{-8}\right)^3\left(cm^3\right)\)
⇒ x = 73,95%