Hòa tan 2.22 g hỗn hợp Al và Fe bằng 500 ml dung dịch HNO3 0.5M thu được dung dịch A và 1.12 (l) duy nhất NO ở đktc a.Tính % khối lượng mỗi kim loại trong hỗn hợp đầu b Cho A tác dụng 210 ml dung dịch NaOH 1M. Rồi lấy kết tủa đem nung ở nhiệt độ cao được bao nhiêu g chất rắn
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


NO3- + 4H+ + 3e ---> NO + 2H2O
nNO = 1.12 / 22.4 = 0.05 mol => nH+ = nHNO3pư = 0.2 mol
nHNO3 đầu = CV = 0.5 x 0.5 = 0.25 mol > 0.2 mol
Vậy HNO3 dư và Al, Fe tan hết. nHNO3 dư = 0.25 - 0.2 = 0.05 mol
Đặt x = nAl, y = nFe: => 27x + 56y = 2.22g
Al - 3e ---> Al3+ và Fe - 3e ---> Fe3+
x.....3x.....................y......3y
=> ne cho = 3x + 3y (mol) => nNO = x + y = 0.05 mol
Giải hệ: x = 0.02 mol; y = 0.03 mol
=> %Al = 0.02 x 27 x 100 / 2.22 = 24.3244% => %Fe = 75.6757%
ddA chứa: Al3+ 0.02 mol, Fe3+ 0.03 mol, HNO3 dư 0.05 mol => số mol ion dương = 0.2 mol
nNaOH = nOH- = 0.21 mol > 0.2 mol. Vậy OH- dư, nOH- dư = 0.21 - 0.2 = 0.01 mol
Fe(OH)3 kết tủa trước vì Fe(OH)3 có tích số tan lớn hơn nhiều Al(OH)3.
Fe3+ + 3OH- ---> Fe(OH)3
nFe(OH)3 = nFe3+ = 0.03 mol
Al3+ + 3OH- ---> Al(OH)3 (1)
nAl(OH)3 (1) = nAl3+ = 0.02 mol
Al(OH)3 + OH- ---> (AlO2)- + 2H2O
nOH- = 0.01 mol => nAl(OH)3 tan = 0.01 mol => nAl(OH)3 còn lại = 0.02 - 0.01 = 0.01 mol
Chất rắn còn lại: Fe(OH)3 0.03 mol, Al(OH)3 0.01 mol
2Fe(OH)3 ---> Fe2O3 + 3H2O...........2Al(OH)3 ---> Al2O3 + 3H2O
0.03.................0.015...............
m (oxit) = 0.015 x 160 + 0.005 x 102 = 2.91g
đừng lấy câu trả lời của người khác và biến nó thành của mình

a, nNO=1.1222.4=0.05(mol)1.1222.4=0.05(mol)
Gọi nAl=a(mol)
.....nFe=b(mol)
Ta có 27a + 56b = 2.22(g) (*)
Quá trình cho e
AlO.................➞ Al+3 + 3e
a......................................3a(mol)
FeO.................➞ Fe+3 + 3e
b......................................3b(mol)
Quá trình nhận e
N+5 + 3e ➞..N+2
.........0.15.....0.05 (mol)
Áp dụng định luật bảo toàn electron ta có
3a + 3b = 0.15(**)
Giải (*) và (**) ta được a=0.02(mol),b=0.03(mol)
%Al=0.02∗272.22∗1000.02∗272.22∗100%=24.324%
%Fe=100%-24.324%=75.676%
b, ddA chứa: Al3+ 0.02 mol, Fe3+ 0.03 mol, HNO3 dư 0.05 mol => số mol ion dương = 0.2 mol
nNaOH = nOH- = 0.21 mol > 0.2 mol. Vậy OH- dư, nOH- dư = 0.21 - 0.2 = 0.01 mol
Fe(OH)3 kết tủa trước vì Fe(OH)3 có tích số tan lớn hơn nhiều Al(OH)3.
Fe3+ + 3OH- ---> Fe(OH)3
nFe(OH)3 = nFe3+ = 0.03 mol
Al3+ + 3OH- ---> Al(OH)3 (1)
nAl(OH)3 (1) = nAl3+ = 0.02 mol
Al(OH)3 + OH- ---> (AlO2)- + 2H2O
nOH- = 0.01 mol => nAl(OH)3 tan = 0.01 mol => nAl(OH)3 còn lại = 0.02 - 0.01 = 0.01 mol
Chất rắn còn lại: Fe(OH)3 0.03 mol, Al(OH)3 0.01 mol
2Fe(OH)3 ---> Fe2O3 + 3H2O...........2Al(OH)3 ---> Al2O3 + 3H2O
0.03.................0.015...............
m (oxit) = 0.015 x 160 + 0.005 x 102 = 2.91g

a) Gọi x và y lần lượt là số mol của Al và Cu.
BTKL: 27x+64y=3,39. (1)
BTe: 3x+2y=3.0,1. (2)
Từ (1) và (2), suy ra x=0,09 và y=0,015, suy ra %mAl\(\approx\)71,68% và %mCu\(\approx\)28,32%.
b) Dung dịch sau khi cô cạn chứa Al3+ (0,09 mol), Cu2+ (0,015 mol) và NO3- (0,3 mol). Chất rắn sau khi nung gồm Al2O3 (0,045 mol) và CuO (0,015 mol). Giá trị m là 5,79 gam.


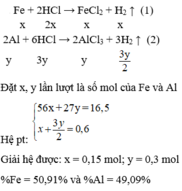
nNO=\(\dfrac{1.12}{22.4}=0.05(mol)\)
Gọi nAl=a(mol)
.....nFe=b(mol)
Ta có 27a + 56b = 2.22(g) (*)
Quá trình cho e
Al0.................➞ Al+3 + 3e
a......................................3a(mol)
Fe0.................➞ Fe+3 + 3e
b......................................3b(mol)
Quá trình nhận e
N+5 + 3e ➞..N+2
.........0.15.....0.05 (mol)
Áp dụng định luật bảo toàn electron ta có
3a + 3b = 0.15(**)
Giải (*) và (**) ta được a=0.02(mol),b=0.03(mol)
%Al=\(\dfrac{0.02*27}{2.22}*100\)%=24.324%
%Fe=100%-24.324%=75.676%
b) bạn tự làm nhé