Bài 4 : Có 2 lọ đựng dd HCl . Lọ thứ nhất có nộng độ 1M , lọ thứ hai có nồng độ 3M .
Hãy pha thành 50 ml dd HCl có nồng độ 2M từ 2 dd trên.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi số ml dd HCl ở lọ 1 và 2 lần lượt là:a;b(ml)
V của dd HCl 1M là:a
V của dd HCl 3M là:3b
Ta có:
CM=\(\dfrac{a+3b}{a+b}=2\)(a+b=50)
\(\Leftrightarrow a+3b=100\)
\(\Leftrightarrow2b=50\)
\(\Leftrightarrow b=25\)
\(\Rightarrow a=25\)
Vậy để pha chế 50 ml dd HCl 2M thì ta cần đổ 25ml dd HCl 1M và 25ml dd HCl 3M
Gọi a, b lần lượt là thể tích dung dịch HCl của lọ thứ 1và lọ thứ 2 (a, b > 0 , lít)
=>: \(a+b=0,05\left(I\right)\)
Ta có: \(n_{HCl}\)(lọ 1) \(=a.1=a\left(mol\right)\)
\(n_{HCl}\)(lọ 2) \(=3b\left(mol\right)\)
\(n_{HCl}\left(sau\right)=2.0,05=0,1\left(mol\right)\)
\(\Rightarrow a+3b=0,1\left(II\right)\)
Từ (I) và (II) \(\Rightarrow\left\{{}\begin{matrix}a=0,025\left(lit\right)=25\left(ml\right)\\b=0,025\left(lit\right)=25\left(ml\right)\end{matrix}\right.\)
Vậy....

HCl 1 : Vdd(1) = mdd/D => mdd= Vdd. D
=> mHCl = (mdd . C%)/100 => số mol HCl
HCl 2 : số mol HCl 2 = CM. Vdd(2)
=> số mol tổng , Vtổng =Vdd1 + Vdd2
=> CM
bài này bạn xem lại dữ liệu khối lượng riêng nhé

Pha chế 50ml dung dịch H 2 S O 4 1,5M.
- Số mol H 2 S O 4 cần pha chế 50ml dung dịch H 2 S O 4 1,5M:
n H 2 S O 4 = CM.V = 1,5.0,05 = 0,075 (mol)
Gọi x(ml) là thể tích của dung dịch H 2 S O 4 1M (1)
Gọi y(ml) là thể tích của dung dịch H 2 S O 4 3M (2)
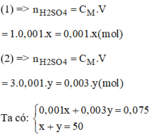
Giải hệ phương trình ta có: x = 37,5ml; y = 12,5ml
- Cách pha chế:
+ Đong lấy 37,5ml dung dịch H 2 S O 4 1M và 12,5ml dung dịch H 2 S O 4 3M cho vào bình, lắc đều, ta được 50ml dung dịch H 2 S O 4 1,5M.

2) Trích mẫu thử :
Cho dung dịch BaCl2 vào 3 mẫu thử :
+ Chất nào xuất hiện kết tủa trắng không tan trong axit : H2SO4
Pt : \(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
Không hiện tượng : HCl , HNO3
Cho dung dịch AgNO3 vào 2 mẫu thử còn :
+ Chất nào xuất hiện kết tủa trắng : HCl
Pt : \(AgNO_3+HCl\rightarrow AgCl+HNO_3\)
Còn lại : HNO3
Chúc bạn học tốt
4) Trích mẫu thử :
Cho quỳ tím vào từng mẫu thử :
+ Hóa đỏ : HCl , H2SO4
+ Hóa xanh : NaOH
+ Không đổi màu : Na2SO4
Cho dung dịch BaCl2 vào 2 mẫu thử làm quỳ tím hóa đỏ :
+ Chất nào xuất hiện kết tủa trắng không tan trong axit : H2SO4
Pt : \(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
Không hiện tượng : HCl
Chúc bạn học tốt

Giải:
Số mol của dd HCl 10% là:
nHCl(1) = (C%.mdd)/(100.M) = (10.150.1,047)/(100.36,5) ≃ 0,43 (mol)
Số mol của dd HCl 2M là:
nHCl(2) = CM.V = 2.0,25 = 0,5 (mol)
Nồng độ mol của dd HCl thu được là:
CMHCl(3) = n/V = (0,43 + 0,5)/(0,15 + 0,25) = 2,325 (M)
Vậy ...
số mol của dd HCL 10% là:
nHCL=(C%.mdd)/(100.M)=(10.150.1.0,47)/(100.36,5)~0,43 (mol)
số mol của dd HCL 2M là:
nHCl=\(_{C_M}\).V=2.0,25=0,5(mol)
nồng đọ mol của dd HCL thu đc là:
\(C_m\)HCL=n/V=(0,43+0,5)/(0,15+0,25)=2,3(M)
vậy dung dịch mới thu được có nồng độ mol là 2,3M

Ta có: m dd HCl (1) = 1,047.150 = 157,05 (g)
\(\Rightarrow m_{HCl\left(1\right)}=157,05.10\%=15,705\left(g\right)\Rightarrow n_{HCl\left(2\right)}=\dfrac{15,705}{36,5}=0,43\left(mol\right)\)
\(n_{HCl\left(2\right)}=0,25.2=0,5\left(mol\right)\)
\(\Rightarrow C_{M_A}=\dfrac{0,43+0,5}{0,15+0,25}=2,325M\)
Giả sử: \(\left\{{}\begin{matrix}n_{Zn}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
⇒ 65x + 56y = 2,7 (1)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Có: \(n_{HCl}=0,04.2,325=0,093\left(mol\right)\)
Theo PT: \(n_{HCl}=2n_{Zn}+2n_{Fe}=2x+2y\left(mol\right)\)
\(\Rightarrow2x+2y=0,093\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=\dfrac{4}{375}\left(mol\right)\\y=\dfrac{43}{1200}\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{\dfrac{4}{375}.65}{2,7}.100\%\approx25,68\%\\\%m_{Fe}\approx74,32\%\end{matrix}\right.\)
Bạn tham khảo nhé!

5)
Cho quỳ tím vào từng chất:
Quỳ tím chuyển đỏ: HCl, H2SO4 ( nhóm 1)
Quỳ tím không đổi màu: NaCl, Na2SO4 ( nhóm 2)
Cho dd Ba(OH)2 dư vào từng nhóm:
Nhóm 1: không hiện tượng là HCl
xuất hiện kết tủa là H2SO4
Ba(OH)2 + H2SO4 -----> BaSO4 + 2H2O
Nhóm 2: không hiện tượng là NaCl
xuất hiện kết tủa là Na2SO4
Ba(OH)2 + Na2SO4 ----> BaSO4 + 2NaOH
6)
Cho quỳ tím vào từng chất
Quỳ tím chuyển đỏ: HCl, H2SO4, HNO3 ( nhóm 1)
Quỳ tím không đổi màu: NaCl, Na2SO4, NaNO3 ( nhóm 2)
Cho dung dịch Ba(OH)2 dư vào nhóm 1:
Tạo kết tủa: H2SO4
Không hiện tượng: HCl, HNO3
Cho dd AgNO3 dư vào thì có kết tủa là: HCl
Còn lại là HNO3
Cho dung dịch Ba(OH)2 dư vào nhóm 2
Tạo kết tủa là Na2SO4
Không hiện tượng: NaCl, NaNO3
Cho dd AgNO3 dư vào thì có kết tủa là: NaCl
Còn lại là NaNO3
7)
Cho quỳ tím vào từng chất:
Quỳ tím chuyển đỏ: HCl, H2SO4 ( nhóm 1)
Quỳ tím chuyển xanh: NaOH, Ba(OH)2 ( nhóm 2)
Cho từng chất ở nhóm 1 tác dụng nhóm 2:
Nếu tạo kết tủa thì là Ba(OH)2 và H2SO4
Còn lại HCl và H2SO4
Phân thành từng nhóm nên khi biết được mỗi cái của từng nhóm là biết cái còn lại rồi
Gọi số ml dd HCl ở lọ 1 và 2 lần lượt là:a;b(ml)
V của dd HCl 1M là:a
V của dd HCl 3M là:3b
Ta có: \(C_m=\dfrac{a+3b}{a+b}=2\left(a+b=50\right)\)
\(\Leftrightarrow a+3b=100\)
\(\Leftrightarrow2b=50\Leftrightarrow b=25\)
\(\Rightarrow a=25\)
Vậy để pha chế 50 ml dd HCl 2M thì ta cần đổ 25ml dd HCl 1M và 25ml dd HCl 3M