Cho hỗn hợp gồm N2, H2 và NH3 đi qua dd H2SO4 đặc, dư thì thể tích khí còn lại là 25%. Thành phần phần trăm theo thể tích của NH3 là
A.25% B. 50% C. 75% D. 33,33%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cho hỗn hợp gồm N2, H2, NH3 đi qua dung dịch H2SO4 đặc, dư thì chỉ có NH3 phản ứng
2NH3+ H2SO4→ (NH4)2SO4
Sau phản ứng thể tích khí còn một nửa
→ %VNH3= 50%

- Đáp án A
- Khi cho hỗn hợp khí (gồm CH4 và C2H4 ) đi qua dung dịch brom thì C2H4 sẽ phản ứng hết với dung dịch brom, CH4 không tác dụng sẽ đi ra khỏi bình.
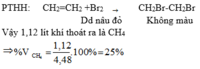

Đáp án D
Gọi a là số nguyên tử C của A, B
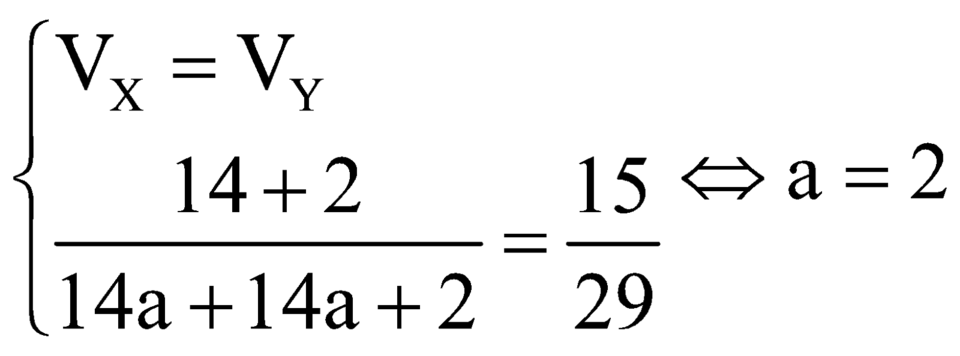
Do đó A, B lần lượt là C2H6, C2H4
Vậy ![]()

a, mCaO = 0,5.56 = 28 (g)
b, \(n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
c, \(n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\)
d, \(V_{hhk}=0,2.22,4+0,3.22,4=11,2\left(l\right)\)
e, \(\%m_{Cu}=\dfrac{64}{64+32+16.4}.100\%=40\%\)
Bạn tham khảo nhé!
a) mCaO=nCaO.M(CaO)=0,5.56=28(g)
b) nCO2=V(CO2,dktc)=6,72/22.4=0,3(mol)
c) nH2SO4=mH2SO4/M(H2SO4)=24,5/98=0,25(mol)
d) V(hh H2,NH3)=(0,3+0,2).22,4=11,2(l)
e) %mCu/CuSO4=(64/160).100=40%
Chúc em học tốt!

Khi cho hỗn hợp gồm N2, H2và NH3 đi qua dung dịch H2SO4 đặc, dư thì toàn bộ NH3 bị hấp thụ.
Theo giả thiết thì sau khi đi qua dung dịch H2SO4 đặc thì thể tích khí còn lại một nửa
\(\rightarrow\)Coi\(\text{ V(NH3 )=1}\) thì\(\text{ V(N2) +V(H2)=1 (1)}\)
\(\frac{\text{(1.17+VN2.28+VH2.2)}}{2}.100\%\)=8x2(2)
Giải (1) và (2) ta có \(\text{V (N2)=0,5, V(NH3)=0,5}\)
%N2=%VH2=\(\frac{0,5}{2}.100\%\)=25%
%NH3 =50%

\(n_{N_2}=a\left(mol\right),n_{H_2}=3a\left(mol\right),n_{NH_3}=b\left(mol\right)\)
\(n_{hh}=4a+b=1\left(mol\right)\)
\(\overline{M}=\dfrac{28a+3a\cdot2+17b}{1}=6.8\cdot2=13.6\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow34a+17b=13.6\)
\(\Leftrightarrow a=0.1,b=0.6\)
\(\%V_{N_2}=10\%,\%V_{H_2}=30\%,\%V_{NH_3}=60\%\)
\(\%m_{N_2}=\dfrac{0.1\cdot28}{13.6}\cdot100\%=20.58\%\)
\(\%m_{H_2}=\dfrac{0.6}{13.6}\cdot100\%=4.41\%\)
\(\%m_{NH_3}=75.01\%\)