Hòa tan hết 19,5g kali vào 261g nước.Nồng độ phần trăm của dung diochj thu được là bao nhiêu ?(Biết rằng nước bay hơi không đáng kể)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nK=0,5(mol)
PTHH: K + H2O -> KOH + 1/2 H2
nKOH=nK=0,5(mol) => mKOH=0,5. 56=28(g)
mddKOH=mK+mH2O-mH2=19,5+ 261- 0,25 x 2= 280(g)
=>C%ddKOH=(28/280).100=10%

200ml = 0,2l
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,2 0,2
\(n_{FeCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(C_{M_{FeCl2}}=\dfrac{0,2}{0,2}=1\left(M\right)\)
Chúc bạn học tốt

Khối lượng KCl có trong 200 g dung dịch KCl ban đầu là:
\(200.20\%=40\left(g\right)\)
Cứ 37 g KCl ở 30oC thì tan trong 100 g nước
Thì 40 g KCl ở 30oC thì tan trong \(\frac{100.40}{37}=108,11\left(g\right)\)
Khối lượng nước bay hơi đi là:
\(200-108,11-40=51,89\left(g\right)\)

\(a.\)
\(m_{dd}=10+40=50\left(g\right)\)
\(C\%=\dfrac{10}{50}\cdot100\%=20\%\)
\(b.\)
\(m_{KOH}=0.25\cdot56=14\left(g\right)\)
\(m_{dd_{KOH}}=14+36=50\left(g\right)\)
\(C\%_{KOH}=\dfrac{14}{50}\cdot100\%=28\%\)

\(n_K=\frac{5,85}{15}=0,15(mol)\\ K+H_2O \to KOH +\frac{1}{2}H_2\\ n_{KOH}=n_K=0,15(mol)\\ n_{H_2}=\frac{1}{2}.n_K=\frac{1}{2}.0,15=0,075(mol)\\ m_{dd}=5,85+100-(0,075.2)=105,7(g)\\ C\%=\frac{0,15.56}{105,7}.100=7,95\%\)
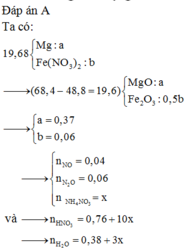

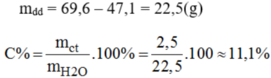
nK = \(\dfrac{19,5}{39}\) = 0,5 mol
2K + 2H2O -> 2KOH + H2
0,5 ->0,5 ->0,25
=>C% = \(\dfrac{0,5.56}{19,5+261-0,25.2}\).100% = 10%
\(C\%=m_{ct}:m_{dd}.100\%=19,5:261.100\%=7,4\%\)