Cân bằng các phương trình hóa học
cần khẩn ạ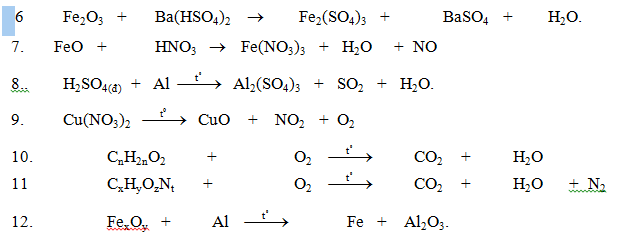
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(Al:\) Chất khử
\(HNO_3:\) Chất OXH
\(Al\rightarrow Al^{+3}+3e\)
\(N^{+5}+1e\rightarrow N^{+4}\)
\(Al+6HNO_3\rightarrow Al\left(NO_3\right)_3+3NO_2+3H_2O\)
\(Al+6HNO_3->Al\left(NO_3\right)_3+3NO_2+3H_2O\)
Chất khử: Al, chất oxh: HNO3
| QT khử | N+5+1e --> N+4 | x3 |
| QT oxh | Al0 -3e--> Al+3 | x1 |

Có 3 yếu tố làm ảnh hưởng đến cân bằng hóa học
- Ảnh hưởng của nhiệt độ đến cân bằng hóa học
VD: N2(k) + 3H2(k) ⇔ 2NH3(k) ∆Ho = -92,6kJ.
Vì ∆H0 < 0, khi nhiệt độ tăng, cân bằng chuyển dịch theo chiều nghịch (chiều thu nhiệt), nếu nhiệt độ của hệ giảm xuống thì cân bằng chuyển dịch theo chiều thuận (chiều tỏa nhiệt).
- Ảnh hưởng của áp suất đến cân bằng hóa học
VD : N2(k) + 3H2(k) ⇔ 2NH3(k)
Có ∆n = 2 – (3 + 1) = -2
+ Nếu P tăng ⇒ cân bằng dịch chuyển theo chiều P giảm (giảm số mol khí ∆n < 0). => Cân bằng chuyển theo chiều thuận
+ Nếu P giảm ⇒cân bằng dịch chuyển theo chiều P tăng (tăng số mol khí ∆n > 0). => Cân bằng chuyển theo chiều nghịch
-Ảnh hưởng của nồng độ đến cân bằng hóa học
C(r)+CO2(k)⇌2CO(k)
- Khi tăng CO2 thì cân bằng chuyển dịch theo chiều thuận (chiều làm giảm CO2).
- Khi giảm CO2 thì cân bằng chuyển dịch theo chiều nghịch (chiều làm tăng CO2).

\(H_2SO_4+3H_2S->4S+4H_2O\)
Chất oxi hóa: H2SO4
Chất khử: H2S
| S+6 + 6e --> S0 | x1 |
| S-2 -2e --> S0 | x3 |
\(S+2HNO_3->H_2SO_4+2NO\)
Chất oxi hóa: HNO3
Chất khử: S
| S0 - 6e --> S+6 | x1 |
| N+5 + 3e --> N+2 | x2 |
\(2KClO_3->2KCl+3O_2\)
| Cl+5+6e-->Cl-1 | x2 |
| 2O3-2 -12e --> 3O20 | x1 |
\(3I_2+10HNO_3->6HIO_3+10NO+2H_2O\)
Chất oxi hóa: HNO3
Chất khử: I2
| I20 -10e --> 2I+5 | x3 |
| N+5 + 3e --> N+2 | x10 |