A là dd HCl có aM, B là Ba(OH)2 có bM. Trộn 300ml A vào 100ml B thu được dd có pH= 13. Tính a, b( xem như khi pha trộn, Vdd không thay đổi)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
\(n_{CuCl_2}=0,1.1,5=0,15\left(mol\right)\)
\(n_{Ca\left(OH\right)_2}=0,3.1=0,3\left(mol\right)\)
PTHH: CuCl2 + Ca(OH)2 --> Cu(OH)2 + CaCl2
Xét tỉ lệ: \(\dfrac{0,15}{1}< \dfrac{0,3}{1}\) => CuCl2 hết, Ca(OH)2 dư
PTHH: CuCl2 + Ca(OH)2 --> Cu(OH)2\(\downarrow\) + CaCl2
_____0,15---->0,15-------->0,15---------->0,15
=> \(\left\{{}\begin{matrix}C_{M\left(Ca\left(OH\right)_2dư\right)}=\dfrac{0,3-0,15}{0,1+0,3}=0,375M\\C_{M\left(CaCl_2\right)}=\dfrac{0,15}{0,1+0,3}=0,375M\end{matrix}\right.\)
b) Khối lượng giảm = khối lượng H2O sinh ra
\(n_{H_2O}=\dfrac{0,9}{18}=0,05\left(mol\right)\)
PTHH: Cu(OH)2 --to--> CuO + H2O
_____0,05<-----------0,05<----0,05
=> mCu(OH)2 = (0,15-0,05).98 = 9,8 (g)
=> mCuO = 0,05.80 = 4(g)
c) \(n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
=> \(n_{SO_2\left(pư\right)}=\dfrac{0,15.80}{100}=0,12\left(mol\right)\)
PTHH: Ca(OH)2 + SO2 --> CaSO3\(\downarrow\) + H2O
_____________0,12------>0,12
=> mCaSO3 = 0,12.120 = 14,4(g)

a, \(n_{OH^-}=10^{-1}.V_A\left(mol\right)\)
\(n_{H^+}=10^{-2}.V_B\left(mol\right)\)
\(n_{OH^-dư}=10^{-2}.\left(V_A+V_B\right)\left(mol\right)\)
Ta có: \(n_{OH^-}-n_{OH^-dư}=n_{H^+}\)
\(\Leftrightarrow10^{-1}.V_A-10^{-2}.\left(V_A+V_B\right)=10^{-2}.V_B\)
\(\Leftrightarrow0,09V_A=0,02V_B\)
\(\Rightarrow\dfrac{V_A}{V_B}=\dfrac{2}{9}\)
b, Ta có: \(\left\{{}\begin{matrix}V_A+V_B=0,55\\\dfrac{V_A}{V_B}=\dfrac{2}{9}\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}V_A=0,1\left(l\right)\\V_B=0,45\left(l\right)\end{matrix}\right.\)
\(n_{BaCl_2}=\dfrac{1}{2}n_{Cl^-}=\dfrac{1}{2}n_{H^+}=\dfrac{1}{2}.10^{-2}.0,1=0,0005\left(mol\right)\Rightarrow m_{BaCl_2}=0,104\left(g\right)\)
\(n_{Ba\left(OH\right)_2}=\dfrac{1}{2}n_{OH^-dư}=\dfrac{1}{2}.10^{-2}.0,55=0,00275\left(mol\right)\Rightarrow m_{Ba\left(OH\right)_2}=0,047025\left(g\right)\)
\(\Rightarrow\%m_{Ba\left(OH\right)_2}=\dfrac{0,047025}{0,047025+0,104}.100\%=31,14\%\)
\(\Rightarrow\%m_{BaCl_2}=62,86\%\)

\(C_{MddHCl}=\dfrac{n}{v}=>^nHCl=0,06\left(mol\right)\)
\(C_{MddBa\left(OH\right)_2}=\dfrac{n}{v}=>^nBa\left(OH\right)_2=0,04\left(mol\right)\)
\(2HCl+Ba\left(OH\right)_2->BaCl_2+2H_2O\)
0,06 0,03
\(\dfrac{0,06}{3}< \dfrac{0,04}{1}=>Ba\left(OH\right)_2\)dư => làm quỳ tím chuyển màu xanh
Khi cô cặn dd X thì có 0,01 mol \(Ba\left(OH\right)_2\)dư và 0,03 mol \(BaCl_2\)
=> \(^mcr=0,01.171+0,03.208=7,95\left(g\right)\)

Ta có : \(n_{H^+}=0,3\times0,05=0,015\left(mol\right)\)
\(n_{OH^-}=2\times a\times0,2=0,4a\left(mol\right)\)
Theo bài \(PH=12\) là môi trường bazo. Vậy OH- hết
PT: \(H^++OH^-\rightarrow H_2O\)
o,4a 0,4a (mol)
\(\Rightarrow H^+dư=0,015-0,4a\)
Ta có : \(\dfrac{0,015-0,4a}{0,5}=10^{-12}\Leftrightarrow a=0,375\left(M\right)\)
Ta có: \(\left\{{}\begin{matrix}n_{H^+}=0,015\left(mol\right)\\n_{OH^-}=0,2a\left(mol\right)\end{matrix}\right.\)
Ta có: pH = 12
=> \(\dfrac{0,015-0,2a}{0,5}=10^{-12}\)
\(\Rightarrow a=0,075\)

Đáp án D
pH =1 => [H+] = 0,1 => n H + = 01.01 = 0,01 mol.
n O H - = 0,1a
pH =12 => [H+] = 10-12 => [OH-] =10-2 => n O H - dư = 0,01.(0,1+0,1) = 0,002 mol
=> 0,1a - 0,01 = 0,002 => a = 0,12.
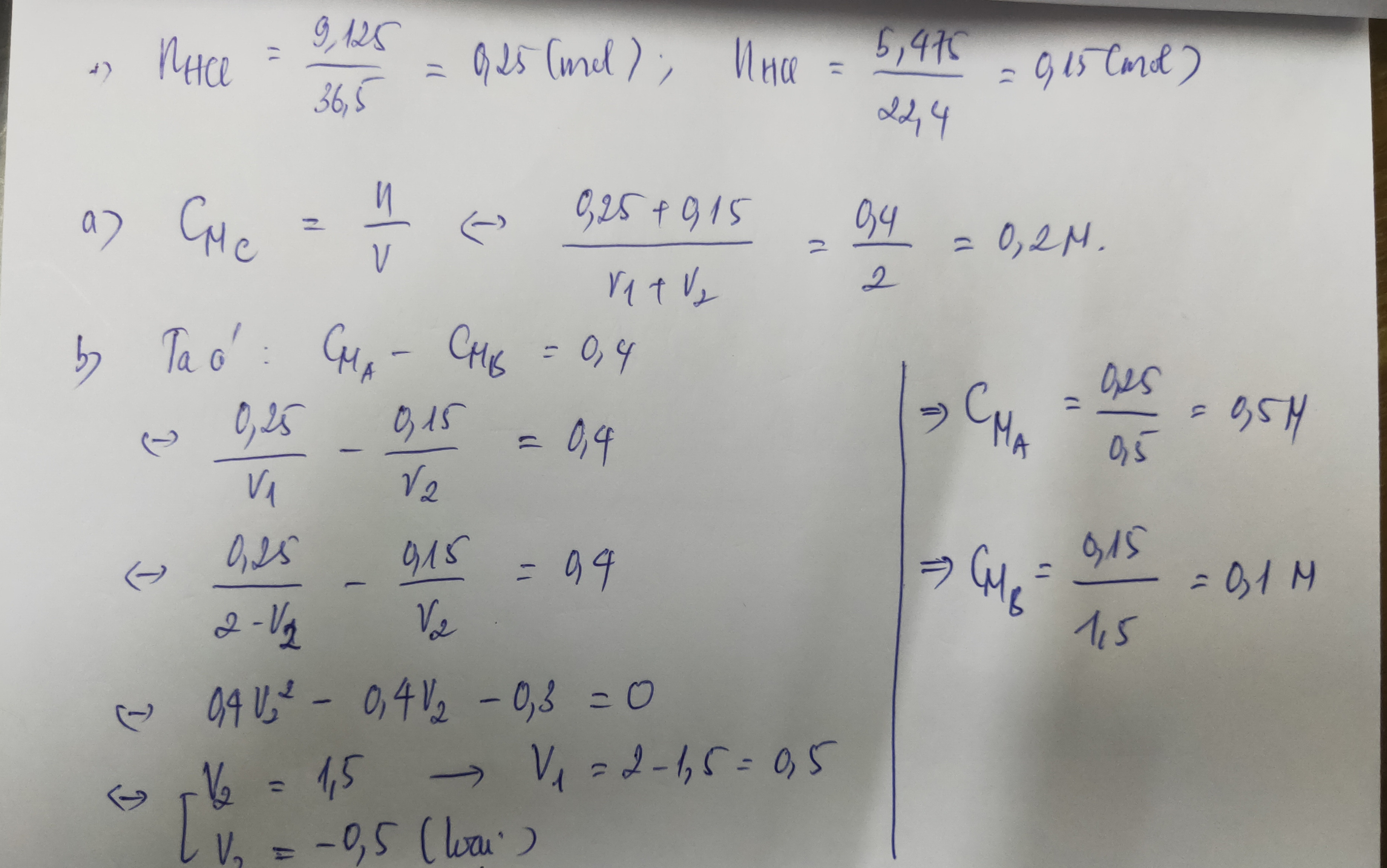
\(pH=13\Rightarrow\left[H^+\right]=10^{-13}\)
\(\Rightarrow\left[OH^-\right]=10^{-1}\)
\(\Rightarrow n_{OH^-dư}=10^{-1}.0,4=0,04\left(mol\right)\)
\(n_{H^+pư}=a\left(mol\right);n_{OH^-pư}=2b\left(mol\right)\)
\(\Rightarrow0,04+a=2b\Leftrightarrow2b-a=0,04\)