Cho từ từ 3,25 gam Kẽm viên vào 120ml dung dịch axit clohiđric 1M. thể tích khí Hiđro sinh ra ở điều kiện tiêu chuẩn là?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


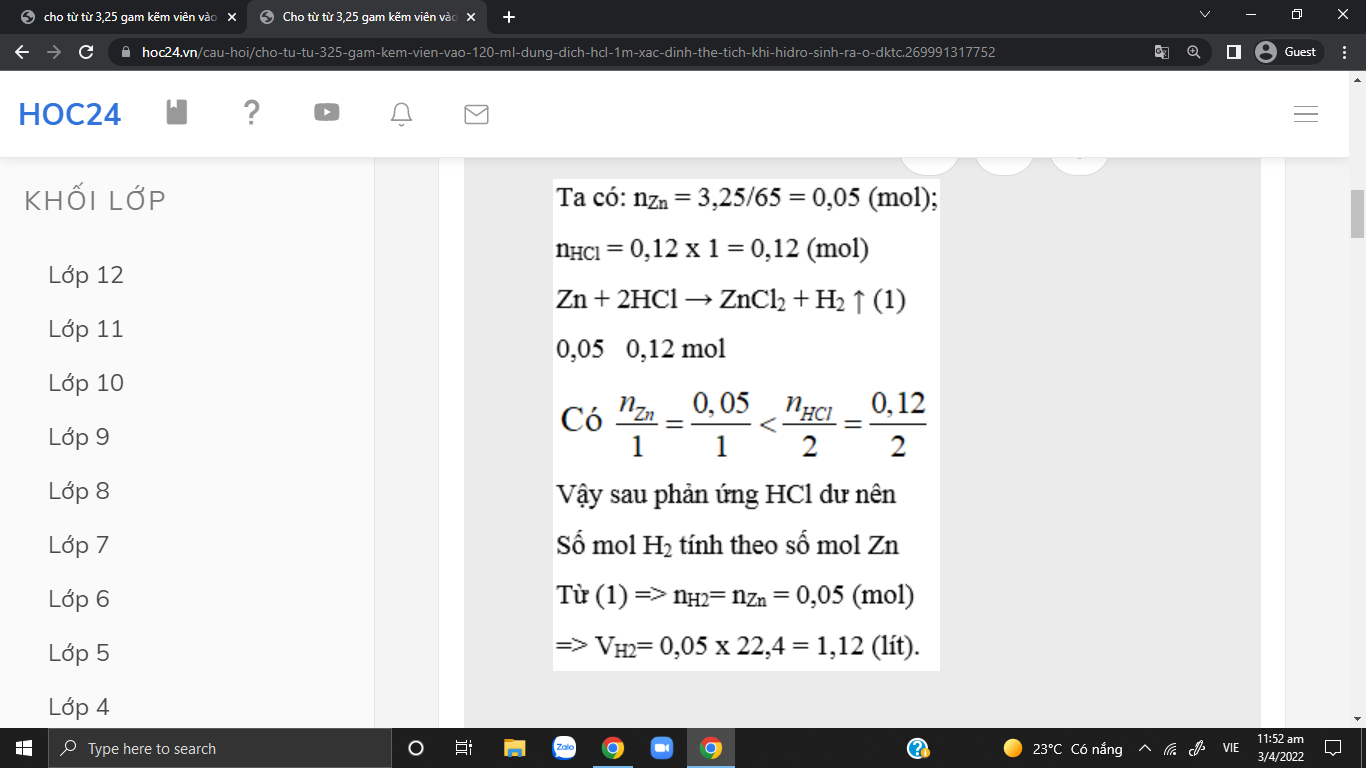
\(n_{Zn}=\dfrac{3,25}{65}=0,05\left(mol\right)\\ n_{HCl}=0,12.1=0,12\left(mol\right)\)
PTHH: Zn + 2HCl ---> ZnCl2 + H2
LTL: \(0,05< \dfrac{0,12}{2}\rightarrow\) HCl dư
Theo pthh: \(n_{H_2}=n_{Zn}=0,05\left(mol\right)\)
=> VH2 = 0,05.22,4 = 1,12 (l)

1) $Zn + 2HCl \to ZnCl_2 + H_2$
2) $n_{H_2} = n_{Zn} = \dfrac{13}{65} = 0,2(mol)$
$V_{H_2} = 0,2.22,4 = 4,48(lít)$

\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\\ a,Mg+2HCl\rightarrow MgCl_2+H_2\\ n_{MgCl_2}=n_{H_2}=n_{Mg}=0,2\left(mol\right);n_{HCl}=0,2.2=0,4\left(mol\right)\\ b,C_{MddHCl}=\dfrac{0,4}{0,1}=4\left(M\right)\\ V_{H_2\left(đktc\right)}=0,2.22,4=4,48\left(l\right)\)

mFe= 8,4/56= 0,15 mol
m HCl = 14,6/36,5=0,4 mol
PTHH: Fe +2HCl →FeCl2 +H2
Bđ: 0,15 0,4 0 0 mol
Pứ: o,15→0,3 0,15 0,15 mol
Sau pứ:0 0,1 0,15 0,15 mol
a. HCl dư: m =0,1.36,5=3,65 g
b. m FeCl2 = 0,15.127=19,05 g
c. m H2 = 0,15.2= 0,3 g
V H2= 0,15.22,4=3,36 (l)
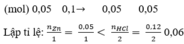




nZn = \(\dfrac{3,25}{65}=0,05\) mol
nHCl = 1 . 0,12 = 0,12 mol
Pt: Zn + 2HCl --> ZnCl2 + H2
0,05 mol--------------------> 0,05 mol
Xét tỉ lệ mol giữa Zn và HCl:
\(\dfrac{0,05}{1}< \dfrac{0,12}{2}\)
Vậy HCl dư
VH2 sinh ra = 0,05 . 22,4 = 1,12 (lít)