Cho 2,8g hỗn hợp gồm FeO; Fe3O4; Fe2O3 tác dụng hoàn toàn với V ml dung dịch HCl thu được dung dịch A. Cho dung dịch A tác dụng với KOH dư, lọc kết tủa rồi nung nóng trong không khí đến khối lượng không đổi thu được 3g chất rắn. Tính V
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H_2} = \dfrac{2,24}{22,4} = 0,1(mol)\)
\(n_{H^+} = n_{HCl} = 0,8(mol)\)
Coi X gồm Fe,O
2H+ + 2e → H2
0,2...........0,2......0,1..................(mol)
2H+ + O2- → H2O
0,6..........0,3.............................(mol)
Bảo toàn electron :
\(2n_{Fe} = 2n_{H_2} + 2n_O\\ \Rightarrow n_{Fe\ pư} = \dfrac{0,3.2+0,1.2}{2} = 0,4(mol)\)
Suy ra :
mX = mFe phản ứng + mO + mFe dư = 0,4.56 + 0,3.16 + 2,8 = 30 gam

Do phản ứng nhiệt nhôm xảy ra hoàn toàn , mà Y + NaOH còn dư chất rắn và tạo khí nên Al dư, Y gồm Al;Al2O3 ; Fe
n Fe= 0,05 mol.
Khi cho Y vào HNO3 thì xảy ra quá tŕnh cho nhận e + Cho e: Al → Al3+ + 3e
Fe → Fe3+ + 3e
+ nhận e : N+5 → N+2 +2e
Theo DLBT e có 3nAl + 3 nFe = 3nNO => nAl = 2a - 0,05
Khi cho Y vào NaOH thì nAl= 2/3 nH2 = 2/3 a
=> a=0,0375 mol => nAl= 0,025 mol
TheoDLBTKL mX =mY = 5,6g => mAl2O3 + mAl= mY - mFe => mAl2O3 = 2,125g
=> nAl ban đầu = nAl + 2nA2O3
=>mAl=1,8g => Chọn A

Đáp án C
Qui đổi hỗn hợp X thành: Fe(a mol) ; Cu(b mol) ; S(c mol) ; O (0,1 mol)
(Vì oxi chiếm 16% về khối lượng => mO = 10.16% = 1,6g => nO = 1,6: 16 = 0,1 mol)
mX = 56a + 64b + 32c + 0,1.16 = 10 (1)
Trong Y có Fe3+ (a mol) ; Cu2+ (b mol) ; SO42-.
Bảo toàn điện tích: 3nFe + 2nCu = 2nSO4 => nSO4 = ½ (3a + 2b)
Bảo toàn S: nS + nH2SO4 = nSO2 + nSO4 muối
=> 0,335 + c = ½ (3a + 2b) + 0,2125 (2)
Cho Mg dư vào Y: Bảo toàn e: nMg pứ. 2 = 3nFe3+ + 2nCu2+ => nMg pứ = ½ (3a + 2b)
mKL tăng = mFe + mCu - mMg pứ => 56a + 64b – 24. ½ (3a + 2b) = 2,8 (3)
Từ (1,2,3) => a = 0,1 ; b = 0,02 ; c = 0,0475 mol
- Oxi hóa X bằng O (Qui O2 và O3 về thành O). Bảo toàn electron:
2nO = 3nFe + 2nCu + 2nS – 2nO(X)
=> 2nO = 3a + 2b + 4c – 2.0,1 => nO = 0,165 mol
- Đặt nO2 = nO3 = u => nO = 2nO2 + 3nO3 = 5u = 0,165 mol => u = 0,033 mol
=> nA = 2u = 0,066 mol
=> V = 1,4784 lit

Chọn B
CO khử được oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại.
→ Hỗn hợp chất rắn Y gồm Cu, Fe, A l 2 O 3 , MgO

\(n_{HCl}=0,4.0,2=0,08\left(mol\right)\\PTHH:\)
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
x------->2x----->x
\(MgO+2HCl\rightarrow MgCl_2+H_2O\)
y------->2y------>y
Có hệ PT: \(\left\{{}\begin{matrix}80x+40y=2,8\\2x+2y=0,08\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,03\\y=0,01\end{matrix}\right.\)
a)
\(m_{CuO}=80.0,03=2,4\left(g\right)\\ m_{MgO}=40.0,01=0,4\left(g\right)\)
b)
\(\%_{m_{CuO}}=\dfrac{2,4.100\%}{2,8}=85,71\%\\ \%_{m_{MgO}}=\dfrac{0,4.100\%}{2,8}=14,29\%\)
c)
\(m_{CuCl_2}=135x=135.0,03=4,05\left(g\right)\)

Đáp án B
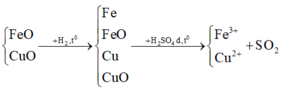
Xét toàn bộ quá trình:
Số oxi hóa của sắt tăng từ +2 lên +3
Số oxi hóa của đồng không thay đổi
Số oxi hóa của hidro tăng từ 0 lên +1
Số oxi hóa của lưu huỳnh giảm từ +6 xuống +4
Áp dụng định luật bảo toàn mol electron cho toàn bộ quá trình ta được:
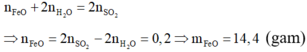
Ta coi như Fe3O4 là hỗn hợp FeO, Fe2O3
Gọi x, y lần lượt là số mol của FeO, Fe2O3 ( x, y > 0 )
FeO + 2HCl → FeCl2 + H2O
x...........................x
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
y..............................2y
FeCl2 + 2KOH → Fe(OH)2 + 2KCl
x................................x
FeCl3 + 3KOH → Fe(OH)3 + 3KCl
2y.................................2y
4Fe(OH)2 + O2 ----to---> 2Fe2O3 + 4H2O
x...........................................0,5x
2Fe(OH)3 ---to---> Fe2O3 + 3H2O
2y..............................y
Ta có hệ
\(\left\{{}\begin{matrix}72x+160y=2,8\\0,5x+y=0,01875\end{matrix}\right.\)
⇒ \(\left\{{}\begin{matrix}x=0,025\\y=0,00625\end{matrix}\right.\)
P/s: ko chắc nx tự tính V ik nha
cho mình sao sao lại có thể thay thế như vậy vậy ?