cho dung dịch bạc nitrat tác dụng với dung dịch hỗn hợp có 6,25 gam muối KCl và KBr thu được 10,39 gam hỗn hợp kết tủa .Tính số mol hỗn hợp ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đặt số mol KCl = a, số mol KBr = b
Ta có:
74,5a + 119b = 12,5
143,5a + 188b = 20,78
=> a = 0,04 và b = 0,08
=> Đáp án B

Câu 1:
Gọi số mol NaCl, KCl là a, b (mol)
=> 58,5a + 74,5b = 6,81 (1)
\(n_{AgCl}=\dfrac{14,35}{143,5}=0,1\left(mol\right)\)
Bảo toàn Cl: a + b = 0,1 (2)
(1)(2) => a = 0,04 (mol); b = 0,06 (mol)
\(\left\{{}\begin{matrix}m_{NaCl}=0,04.58,5=2,34\left(g\right)\\m_{KCl}=0,06.74,5=4,47\left(g\right)\end{matrix}\right.\)
Câu 2:
Gọi số mol MgCl2, KCl là a, b (mol)
=> 95a + 74,5b = 3,93 (1)
25ml dd A chứa \(\left\{{}\begin{matrix}MgCl_2:0,05a\left(mol\right)\\KCl:0,05b\left(mol\right)\end{matrix}\right.\)
nAgNO3 = 0,05.0,06 = 0,003 (mol)
=> nAgCl = 0,003 (mol)
Bảo toàn Cl: 0,1a + 0,05b = 0,003 (2)
(1)(2) => a = 0,01 (mol); b = 0,04 (mol)
\(\left\{{}\begin{matrix}\%m_{MgCl_2}=\dfrac{0,01.95}{3,93}.100\%=24,173\%\\\%m_{KCl}=\dfrac{0,04.74,5}{3,93}.100\%=75,827\%\end{matrix}\right.\)

Đáp án A
m X = 136a => m O = 11,36 => n O = 0,71 mol
Quy đổi hỗn hợp X về a mol Mg, 2a mol Fe và 0,71 mol O.
Y tác dụng với HNO3 dư tạo ra khí NO, N2O và dung dịch chứa muối NH4NO3.
Cô cạn dung dịch thu được rắn chứa a mol Mg(NO3)2 , 2a mol Fe(NO3)3 và NH4NO3.
→ n N H 4 N O 3 = 0 , 1875 a
Do vậy số mol NO và N2O đều là 0,1875a.
Bảo toàn e: 2a + 2a.3 = 0,71.2 + 0,1875a.3 + 0,1875a.8 + 0,1875a.8
Giải được: a=0,32.
Đốt hỗn hợp X bắng Cl2 và O2 thu được Z.
Hòa tan Z cần 1,6 mol HCl → n O = 0 , 8 → n O 2 = 0 , 4
Gọi số mol Cl2 là x , kết tủa thu được là AgCl 2x +1,6 và Ag.
Bảo toàn e: n A g = 0,32.2 + 0,64.3 - 0,8.2 - 2x = 0,06 - 2x
=> 108(0,96 - 2x) + (108 + 35,5)(2x + 16) = 354,8
Giải được: x=0,3.
=> V = (0,3 + 0,4).22,4 = 15,68

Chọn B.
![]()
Quy đổi hỗn hợp X về a mol Mg, 2a mol Fe và 0,71 mol O.Y tác dụng với HNO3 dư tạo ra khí NO, N2O và dung dịch chứa muối NH4NO3.Cô cạn dung dịch thu được rắn chứa a mol Mg(NO3)2 , 2a mol Fe(NO3)3và NH4NO3.
![]()
Do vậy số mol NO và N2O đều là 0,1875a. Bảo toàn e:
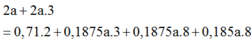
Giải được: a=0,32.
Đốt hỗn hợp X bắng Cl2 và O2 thu được Z. Hòa tan Z cần 1,6 mol HCl
![]()
Gọi số mol Cl2 là x , kết tủa thu được là AgCl 2x +1,6 và Ag.
Bảo toàn e:
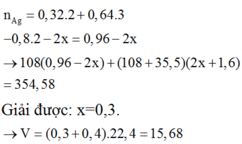

Đáp án A
m X = 136 a → m O = 11 , 36 → n O = 0 , 71 m o l
Quy đổi hỗn hợp X về a mol Mg, 2a mol Fe và 0,71 mol O.
Y tác dụng với HNO3 dư tạo ra khí NO, N2O và dung dịch chứa muối NH4NO3.
Cô cạn dung dịch thu được rắn chứa a mol Mg(NO3)2 , 2a mol Fe(NO3)3 và NH4NO3 → n N H 4 N O 3 = 0 , 1875 a
Do vậy số mol NO và N2O đều là 0,1875a.
Bảo toàn e: 2a+2a.3=0,71.2+0,1875a.3+0,1875a.8+0,1875a.8
=> a= 0,32
Đốt hỗn hợp X bắng Cl2 và O2 thu được Z.
Hòa tan Z cần 1,6 mol HCl → n O = 0 , 8 → n O 2 = 0 , 4
Gọi số mol Cl2 là x , kết tủa thu được là AgCl 2x +1,6 và Ag.
Bảo toàn e:
n A g = 0 , 32 . 2 + 0 , 64 . 3 - 0 , 8 . 2 - 2 x = 0 , 96 - 2 x → 108 ( 0 , 96 - 2 x ) + ( 108 + 35 , 5 ) ( 2 x + 1 , 6 ) = 354 , 58
Giải được: x=0,3.
=> V= (0,3+0,4).22,4= 15,68

Gọi : \(\left\{{}\begin{matrix}n_{KF}=a\left(mol\right)\\n_{KCl}=a\left(mol\right)\\n_{KBr}=3a\left(mol\right)\\n_{KI}=3a\left(mol\right)\end{matrix}\right.\)⇒ 58a + 74,5a + 3a.119 + 3a.166=98,75
⇒ a = 0,1
KCl + AgNO3 → AgCl + KNO3
0,1........................0,1....................(mol)
KBr + AgNO3 → AgBr + KNO3
0,3.........................0,3......................(mol)
KI + AgNO3 → AgI + KNO3
0,3....................0,3.............................(mol)
Vậy :
a = 0,1.143,5 + 0,3.188 + 0,3.235 = 141,25(gam)

Trường hợp 1:
Cả 2 muối cùng phản ứng
Gọi số mol
AgCl : x mol ; AgBr: y mol
\(\left\{{}\begin{matrix}74,5x+119y=87,4\\143,5x+188y=33,15\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=-4,07\\y=3,28\end{matrix}\right.\)
Có nghiệm âm, loại
Trường hợp 2
Chỉ có KCl tác dụng
\(n_{AgCl}=\frac{33,15}{143,5}=0,23\left(mol\right)\)
\(n_{AgCl}=n_{KCl}=0,23\left(mol\right)\)
\(m_{KCl}=0,23.74,5=17,135\left(g\right)\)
\(m_{KBr}=87,4-17,35=70,265\left(g\right)\)
Trường hợp 3:
Chỉ có KBr tác dụng:
\(n_{AgBr}=\frac{33,15}{188}=0,18\left(mol\right)\)
\(n_{AgBr}=n_{KBr}=0,18\left(mol\right)\)
\(m_{KBr}=0,18.119=21,42\left(g\right)\)
\(m_{KCl}=87,4-21,42=65,98\left(g\right)\)


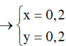
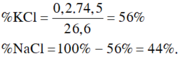
KCl +AgNO3 --> KNO3 + AgCl (1)
KBr +AgNO3 --> KNO3 +AgBr (2)
giả sử nKCl=x(mol)
nKBr=y(mol)
=>\(\left\{{}\begin{matrix}74,5x+119y=6,25\\143,5x+188y=10,39\end{matrix}\right.=>\left\{{}\begin{matrix}x=0,02\left(mol\right)\\y=0,04\left(mol\right)\end{matrix}\right.\)
=> nhh=0,06(mol)