Cho 4,48l khí CO( đktc) từ từ đi qua ống sứ nung nóng đựng 8g FexOy, xảy ra phản ứng hoàn toàn theo sơ đồ sau:
FexOy + CO ---> Fe + CO2
Sau phản ứng người ta thu được hỗn hợp khí X có tỉ khối với H2=20
1. Cho biết PT hỗn hợp trên và xác định công thức của oxit sắt
2. Tính % theo thể tích của khí CO2 trong hỗn hộ khí X.

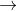 CO2
CO2 = 0,2 (mol)
= 0,2 (mol) . 100% = 75%
. 100% = 75%
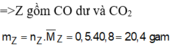
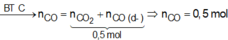
FexOy + yCO => (to) xFe + yCO2
nCO = V/22.4 = 4.48/22.4 = 0.2 (mol)
Hỗn hợp khí X gồm: CO2 và COdư
dX/H2 = 20 => X = 20x2 = 40
Theo sơ đồ đường chéo, ta có:
CO = 28; CO2 = 44; X = 40
=> tỉ lệ CO : CO2 = 4/12 = 1/3
\(\frac{CO_{dư}}{CO2}=\frac{1}{3}=\frac{CO_{dư}}{CO_{pứ}}\)
Mà ta có: COdư + COpứ = 0.2 (mol)
Suy ra : COpứ = 0.15 (mol)
=> nFexOy = 0.15/y
Ta có: 56x + 16y = \(\frac{8}{\frac{0.15}{y}}=\frac{160}{3}y\)
=> 56x = 112/3 y => x/y = 2/3
Vậy CT là: Fe2O3.
nCO2 = nCO pứ = 0.15 (mol)
nCO dư = 0.05 (mol)
=> % VCO2 = 0.15x22.4x100/(0.05+0.15)x22.4 =75%