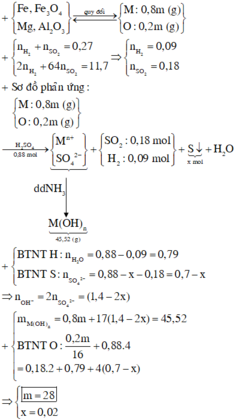
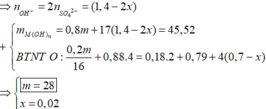cho m gam hỗn hợp Mg , Fe,MgO,Fe3O4 (oxi chiếm 20% về khối lượng) tác dụng với 61,6% H2SO4 140g (có nhiệt độ) thu được 6,048l hỗn hợp H2;SO2 có tỷ khối so với khí He là 10,833 và dd Y .Cho Y td với NaOH dư thu được 45,52g kết tủa.tìm m?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đặt CT chung 3 KL là R có hóa trị chung là n
\(PTHH:4R+nO_2\xrightarrow{t^o}R_2O_n\\ R_2O_n+nH_2SO_4\to R_2(SO_4)_n+nH_2O\\ \Rightarrow n_{H_2SO_4}=n_{H_2O}\\ \text {Bảo toàn KL: }m_{R_2O_n}+m_{H_2SO_4}=m_{R_2(SO_4)_3}+m_{H_2O}\\ \Rightarrow 2,8+98n_{H_2SO_4}=6,8+18n_{H_2SO_4}\\ \Rightarrow n_{H_2SO_4}=0,05(mol)\\ \Rightarrow V=V_{dd_{H_2SO_4}}=\dfrac{0,05}{1}=0,05(l)=50(ml)\\ \text {Ta có: }n_{O_2}=\dfrac{n_{R_2O_3}}{2}.n;n_{R_2O_3}=\dfrac{n_{H_2SO_4}}{n}\\ \Rightarrow n_{O_2}=\dfrac{n_{H_2SO4}}{2}=0,025(mol)\\ \Rightarrow m_{O_2}=0,025.32=0,8(g)\\ \text {Bảo toàn KL: }m=m_R+m_{O_2}=m_{R_2O_n}\\ \Rightarrow m=m_R=2,8-0,8=2(g)\)

Coi hỗn hợp X gồm R ( có hoá trị n - a mol) và Fe (b mol)
$\Rightarrow Ra + 56b = 6$
$2R + 2nHCl \to 2RCl_n + nH_2$
$Fe + 2HCl \to FeCl_2 + H_2$
Theo PTHH : $n_{H_2} = 0,5an + b = \dfrac{1,85925}{22,4} = 0,083(mol)(1)$
$2R + nCl_2 \xrightarrow{t^o} 2RCl_n$
$2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3$
$m_{Cl_2} = m_{muối} - m_X = 12,39 - 6 = 6,39(gam)$
$n_{Cl_2} = 0,5an + 1,5b = 0,09(2)$
Từ (1)(2) suy ra : an = 0,138 ; b = 0,014
$\%m_{Fe} = a\% = \dfrac{0,014.56}{6}.100\% = 13,07\%$

n O = 39,2.18,367%/16 = 0,45(mol)
Bảo toàn e :
n SO4 2-(trong muối) = n e cho = 2n O + 2n SO2 = 0,45.2 + 0,4.2 = 1,7(mol)
Bảo toàn nguyên tố với S :
n H2SO4 pư = n SO4 2-(trong muối) + n SO2 = 1,7 + 0,4 = 2,1(mol)
=> n H2SO4 đã dùng = 2,1/(100% -20%) = 2,625(mol)
=> a = CM H2SO4 = 2,625/2,5 = 1,05(M)