Cho 1,1g hỗn hợp bột sắt và bột nhôm tác dụng vừa đủ với 1,28g bột lưu huỳnh.
a, Viết PTHH của các phản ứng đã xảy ra
b, Tính tỉ lệ % của sắt và nhôm trong hỗn hợp ban đầu theo:
+Số mol
+Khối lượng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)Phương trình hóa học của phản ứng.
Fe + S -> FeS
xmol xmol
2Al + 3S -> Al2S3.
ymol 1,5y.
b) Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu:
Ta có (mol).
Ta có hệ phương trình :
Giải hệ phương trình được y = 0,02 => mAl = 0,02.27 = 0,54g.
x = 0,01 => mFe =0,01.56 = 0,56 gam.
%mAl = %.
%mFe = 50,91 %.
Theo lượng chất :
%nAl = 66,67%.
%Fe = 33,33%.
)Phương trình hóa học của phản ứng.
Fe + S -> FeS
xmol xmol
2Al + 3S -> Al2S3.
ymol 1,5y.
b) Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu:
Ta có
(mol).
Ta có hệ phương trình :
Giải hệ phương trình được y = 0,02 => mAl = 0,02.27 = 0,54g.
x = 0,01 => mFe =0,01.56 = 0,56 gam.
%mAl =
%.
%mFe = 50,91 %.
Theo lượng chất :

Gọi nFe = x mol, theo PT ⇒ nS (1) = nFe = x mol
Gọi nAl = y mol, theo PT ⇒ nS (2) = 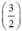 . nAl =
. nAl = 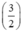 . y mol
. y mol
⇒ nS = x + 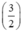 . y = 0,04 mol.
. y = 0,04 mol.
mhh = 56x + 27y = 1,1.
Giải hệ phương trình ta có x = 0,01 mol, y= 0,02 mol.
Tỉ lệ % sắt và nhôm trong hỗn hợp theo lượng chất ( theo số mol là):
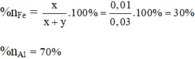
Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp theo khối lượng chất:
mAl = 0,02 x 27 = 0,54g
mFe = 0,01 x 56 = 0,56g.
%mAl = 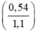 × 100% = 49,09%
× 100% = 49,09%
%mFe = 100% - 49,09% = 50,91%

a. Fe + S \(\rightarrow\) FeS
2Al + 3S \(\rightarrow\) Al2S3
b. Gọi x, y lần lượt là số mol của sắt và nhôm ta có:
PT: Fe + S \(\rightarrow\) FeS
theo đề x(mol) x(mol)
2Al + 3S \(\rightarrow\) Al2S3
y(mol) (3/2)y (mol)
Theo đề bài ta có hệ: 56x + 27y = 1,1
x + (3/2)y = 1,28/32= 0.04
Giải hệ ta được x= 0.01; y=0.02
KHối lượng sắt trong hỗn hợp là:56x = 56x0.01=0.56 g
+> %Fe=(0.56/1.1)x100%= 50.9%
=> %Al= 100% - 50.9% = 49,1%

Fe + S → FeS
x x (mol)
2Al + 3S → t ° Al 2 S 3
y 3y/2(mol)
Đặt số mol Fe, Al lần lượt là x,y ta có hệ phương trình:
56x + 27y = 1,1
(x +3y/2).32 = 1,28
Giải ra x = 0,01 và y = 0,02
% n Fe = 0,01/0,03 x 100% = 33,33%; % n Al = 100 - 33,33% = 66,667%
% m Fe = 56.0,01/1,1 x 100% = 50,90%; % m Al = 100 - 50,90 = 49,1 (%)

Phương trình hóa học của phản ứng
Fe + S → FeS
2Al + 3S → Al2S3
a,
x =>x
y ==> 3/2* y
b, ta có:
56x + 27 y=1,1 (I)
32x + 32*3/2*y=1,28(II)
từ (I) (II)=>x= 0,01
y= 0,02
suy ra : %nFe= 0,01*100%/(0,01+0,02)= 33,3%
%nAl= 100%-33,3%=66,7%
%mfe= (0,01*56)*100%/1,1=50,9%
%mAl= 100%-50,9%=49,1%