Một hỗn hợp gồm Zn và Fe có khối lượng là 37,2 gam. Hòa tan hỗn hợp này trong 2 lít dung dịch H2SO4 0,5M. Chứng tỏ rằng hỗn hợp này tan hết.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
\(n_{H_2SO_4}=2.0,5=1\left(mol\right)\)
Giả sử hỗn hợp chỉ có Fe (Do MFe < MZn)
=> \(n_{Fe}=\dfrac{37,2}{56}=\dfrac{93}{140}\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
\(\dfrac{93}{140}\)--> \(\dfrac{93}{140}\)
=> \(n_{H_2SO_4\left(pư\right)}=\dfrac{93}{140}< 1\)
=> A tan hết
b)
Giả sử hỗn hợp chỉ có Zn (Do MFe < MZn)
\(n_{Zn}=\dfrac{37,2.2}{65}=\dfrac{372}{325}\left(mol\right)\)
PTHH: Zn + H2SO4 --> ZnSO4 + H2
\(\dfrac{372}{325}\)--> \(\dfrac{372}{325}\)
=> \(n_{H_2SO_4\left(pư\right)}=\dfrac{372}{325}>1\)
=> A không tan hết
a)
\(n_{H_2SO_4}=2.0,5=1\left(mol\right)\)
Giả sử hỗn hợp chỉ có Fe (Do MFe < MZn)
=> \(n_{Fe}=\dfrac{37,2}{56}=\dfrac{93}{140}\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
\(\dfrac{93}{140}\)--> \(\dfrac{93}{140}\)
=> \(n_{H_2SO_4\left(pư\right)}=\dfrac{93}{140}< 1\)
=> A tan hết
b)
Giả sử hỗn hợp chỉ có Fe (Do MFe < MZn)
\(n_{H_2SO_4\left(pư\right)}=2.\dfrac{93}{140}=\dfrac{93}{70}>1\)
=> A không tan hết

co MZn >M Fe -> neu hon hop toan la Fe -> trong 37,2g co nFe > n Fe +nZn hay noi cach khac la so mol chat trong 37,2g Fe lon hon so gam chat trong 37,2 g hon hop Fe,Zn,
neu hon hop toan Fe -> n Fe = 37.2 : 56=0.66 mol
n H2 SO4 = 2x 0.5 = 1 mol
Fe tac dung voi H2 SO4 theo ti le 1:1
-> 37.2g Fe tan het.=> nFe < nH2SO4 hien co.ma nFe> n Fe+n Zn=> hon hop tan het
b.neu dung luong gap doi lan truoc la : 74.4g
gia su hon hop toan Zn -> nZn <n Fe +n Zn
nZn = 74.4 : 65=1.14 mol > n H2SO4 => ko phan ung het,Zn du
ma nZn < n Fe+ n Zn => hon hop ban dau khong tan het
c.n CuO = 0.6 mol
n H2 = n Cuo= 0.6 mol = n Fe + n Zn (1)
nFe x 56 + n Zn x 65 = 37,2 (2)
giai he phuong trinh 1 va 2 => n Fe =0.2 mol => m Fe =11.2g
n Zn= 0.4 mol => m Zn =26
Phần b bạn ko tính số mol của các chất à...vậy tính sao bây h -_-

a. Có các phản ứng hóa học xảy ra:
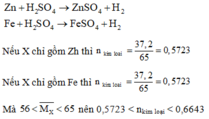
Ta có: n H 2 S O 4 phản ứng = nkim loại < 0,6643
Mà: n H 2 S O 4 ban đầu = 1 > 0,6643 nên sau phản ứng kim loại tan hết, axit còn dư.
b. Khi sử dụng lượng X gấp đôi thì 0,5723.2 < nkim loại < 0,6643.2
Hay 1,1446 < nkim loại < 1,3286
Mà nếu các kim loại bị hòa tan hết thì n H 2 S O 4 phản ứng = nkim loại > 1,1446
Do n H 2 S O 4 thực tế = 1 < 1,1446 nên sau phản ứng kim loại chưa tan hết.
Đán án A

+ HCl và Cl2 đều đóng vai trò chất oxi hóa, mấu chốt của bài toán ta cần nhận ra được: Zn, Mg có hóa trị không đổi; Fe có nhiều hóa trị, cụ thể khi tác dụng với dung dịch thu được muối sắt (II), còn khi tác dụng với Cl2 thu được muối sắt (III).
+ Sử dụng công thức tính nhanh số mol Fe trong X:
![]()
![]()
![]()
Đáp án D

Đáp án D
Bảo toàn e:
+) X + HCl: 2nZn + 2nMg + 2nFe = 2nH2 = 1,0 mol
+) X + Cl2: 2nZn + 2nMg + 3nFe = 2nCl2 = 1,1 mol( khi phản ứng với Cl2, Fe thể hiện hóa trị 3)
⇒ nFe = 1,1 - 1,0 = 0,1 mol ⇒ mFe = 5,6 g

Đáp án : A
nH2 = 0,25 mol; nSO2 = 0,3 mol
2H+ + 2e → H2 S+6 + 2e → S+4
0,5 <-- 0,25 0,6 <-- 0,3
nFe = 0,6 – 0,5 = 0,1 mol
=> mFe = 5,6g
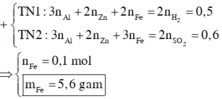
nH2SO4=0,5.2=1(mol)
Zn+H2SO4--->ZnSO4+H2
x____x
Fe+H2SO4--->FeSO4+H2
y_____y
Giả sự hh toàn là Zn
Ta có: 65x+65y>65x+56y
=>65x+65y>37,2
=>x+y>0,57 (*)
Giả sự hh toàn là Fe
Ta có: 56x+56y<65x+56y
=>56x+56y<37,2
=>x+y<0,66(*)
Mặt khác: nH2SO4=x+y=1
Mà n 2 kim loại= 0,57<x+y<0,66
=>Hỗn hợp tan hết