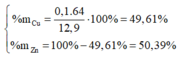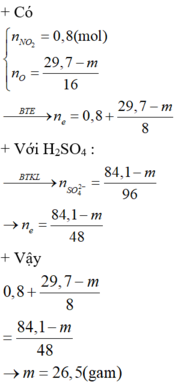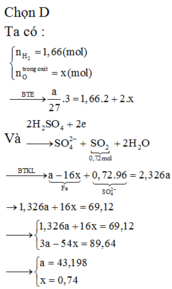Khi cho kim loại tác dụng với dung dịch H2SO4 (đặc, nóng), thu được muối sunfat, các sản phẩm chứa lưu huỳnh (như H2S, S hoặc SO2), không thu được khí H2. Hòa tan 32,3 gam hỗn hợp X gồm Zn và Cu trong m gam dung dịch H2SO4 78,4% (đặc, nóng). Sau khi phản ứng xảy ra hoàn toàn, thu được 2,24 lít (đktc) khí SO2 (sản phẩm khí duy nhất), dung dịch Y và 9,6 gam hỗn
hợp Z gồm 2 chất rắn có tỷ lệ số mol 1:1.
a)Viết các phương trình hóa học xảy ra.
b) Tính thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp X và tìm m.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có số mol e kim loại nhường là (19,7 - m)/8 + 0,8
Ta có số mol e nhận tạo khi SO2 là (19,7 -m)/8 + 0,8 => Số mol SO2 là (29,7 - m)/16 + 0,4
Trong phản ӭng với H2SO4 đặc, ta có số mol H2SO4 = số mol H2O = 2 số mol SO2
Áp dụng bảo toàn khối lượng => m = 26,5
=> Đap an C

TH1: Hóa trị `M` đổi `->M:\ Fe`
`Fe^0->Fe^{+2}+2e`
`2H^{-1}+2e->H_2^0`
Bảo toàn electron: `n_{Fe}=n_{H_2}=0,14(mol)`
`->n_{Cu}={11,2-0,14.56}/{64}=0,0525(mol)`
`Cu^0->Cu^{+2}+2e`
`Fe^0->Fe^{+3}+3e`
`S^{+6}+2e->S^{+4}`
Bảo toàn electron: `2n_{Cu}+3n_{Fe}=2n_{SO_2}=0,525`
`->2.0,0525+3.0,14=0,525`
Nhận.
`->M` là Iron `(Fe).`
TH2: Hóa trị `M` không đổi.
`M` hóa trị `n`
Đặt `n_{Cu}=x(mol);n_M=y(mol)`
`M^0->M^{+n}+n.e`
`2H^{-1}+2e->H_2^0`
Bảo toàn electron: `ny=2n_{H_2}=0,28`
`->y={0,28}/n(mol)`
`M^0->M^{+n}+n.e`
`Cu^0->Cu^{+2}+2e`
`S^{+6}+2e->S^{+4}`
Bảo toàn electron: `2x+ny=2n_{SO_2}=0,525`
`->x={0,525-0,28}/2=0,1225(mol)`
`->m_M=11,2-0,1225.64=3,36(g)`
`->M_M={3,36}/{{0,28}/n}=12n`
`->n=2;M_M=24`
`->M` là magnesium `(Mg).`
Vậy `M` là `Mg` hoặc `Fe.`

Giả sử: \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\\n_{Cu}=c\left(mol\right)\\n_{Al}=d\left(mol\right)\end{matrix}\right.\)
_ Khi tác dụng với HCl.
Ta có: \(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
Theo ĐLBT mol e, có: 2a + 2b + 3d = 0,45.2 ⇒ 2a + 2b + 3d = 0,9 (1)
_ Khi tác dụng với H2SO4 đặc nóng.
Ta có: \(n_{SO_2}=\dfrac{10,64}{22,4}=0,475\left(mol\right)\)
Theo ĐLBT mol e, có: 2a + 2b + 2c + 3d = 0,475.2
⇒ 2a + 2b - 2c + 3d = 0,95 (2)
Trừ 2 vế của (1) và (2), có: c = 0,025 (mol)
\(\Rightarrow\%m_{Cu}=\dfrac{0,025.64}{14,7}.100\%\approx10,88\%\)
Bạn tham khảo nhé!
Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\\n_{Cu}=c\left(mol\right)\\n_{Al}=d\left(mol\right)\end{matrix}\right.\)
Ta có: \(\left\{{}\begin{matrix}n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\\n_{SO_2}=\dfrac{10,64}{22,4}=0,475\left(mol\right)\end{matrix}\right.\)
Bảo toàn electron: \(\left\{{}\begin{matrix}2a+2b+2c+3d=0,475\cdot2\\2a+2b+3d=0,45\cdot2\end{matrix}\right.\)
\(\Rightarrow2c=0,475\cdot2-0,45\cdot2=0,05\) \(\Rightarrow c=0,025\)
\(\Rightarrow\%m_{Cu}=\dfrac{0,025\cdot64}{14,7}\cdot100\%\approx10,88\%\)

Đáp án B
Đặt nCu = x(mol); nZn=y(mol)
=> 64x + 65y = 12,9
Bảo toàn electron ta lại có: ne nhường = ne nhận
=> 2 . n Cu + 2 . n Zn = 2 n SO 2 + 6 n S
=> 2x + 2y = 0,4 => x = y = 0,1 (mol)
Vậy phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu là: