chia hỗn hợp x gồm mg và fe thành 2 phần bằng nhau. cho một phần tác dụng vớimột lượng dung dịch H2SO4 loãng thu được 1,334 lít H2. phần 2 tác dụng với một lượng dung dịch H2SO4 đặc nóng thu được 1,68 lít SO2
a,tính thành phần phần trăm khối lượng mỗi kim loại trong hỗn hợp X
b,hấp thụ hoàn toàn lượng SO2 trên vào 10ml dung dịch NaOH 1M thu được dung dịch A. tính khối lượng các muối tạo thành trong dung dịch A

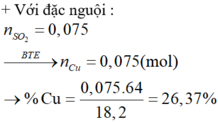


ngoài ra SO\(_2\) dư còn tác dụng với \(H_2O\):
\(SO_2\)+H\(_2O\)\(\rightarrow\)H\(_2SO_3\)
0,07 0,07 (mol)
m\(_{H_2SO_3}\)=0,07.82=5,74(g)
\(CM_{H_2SO_3}\)=\(\dfrac{0,07}{0,01}\)=7M
đây chỉ là mở rộng thôi,chứ trong đề bạn đưa chỉ yêu cầu tính khối lượng muối thôi,chứ không yêu cầu tính khối lượng và nồng độ mol của axit
a/
Fe+H\(_2SO_{4\left(l\right)}\)\(\rightarrow\)FeSO\(_4\)+H\(_2\uparrow\)
a a (mol)
Mg+H\(_2SO_{4\left(l\right)}\)\(\rightarrow\)MgSO\(_4+H_2\uparrow\)
a b (mol)
n\(_{H_2}\)=\(\dfrac{1,334}{22,4}\)\(\simeq\)0,06(mol)
2Fe+6H\(_2SO_{4\left(đn\right)}\)\(\rightarrow\)\(Fe_2\left(SO_4\right)_3\)+6\(H_2O\)+3SO\(_2\uparrow\)
a 3/2a (mol)
Mg+2H\(_2SO_{4\left(đn\right)}\)\(\rightarrow\)\(MgSO_4\)+2\(H_2O\)+\(SO_2\uparrow\)
b b (mol)
n\(_{SO_2}\)=\(\dfrac{1,68}{22,4}\)=0,075(mol)
gọi số mol của Fe trong mỗi phần là a;Mg là b,ta có hệ phương trình:
a+b=0,06
\(\dfrac{3}{2}a\)+b=0,075
\(\Leftrightarrow\)a=0,03(mol)
b=0,03(mol)
n\(_{Fe}\)=0,03.2=0,06
\(\Rightarrow\)m\(_{Fe}\)=0,06.56=3,36(g)
n\(_{Mg}\)=0,03.2=0,06
\(\Rightarrow\)m\(_{Mg}\)=0,06.24=1,44(g)
m\(_X\)=3,36+1,44=4,8(g)
\(\rightarrow\)%m\(_{Fe}\)=\(\dfrac{3,36}{4,8}.100\%\)=70%
\(\Leftrightarrow\)%m\(_{Mg}\)=100%-70%=30%
b/
n\(_{NaOH}\)=0,01.1=0,01(mol)
2NaOH+\(SO_2\)\(\rightarrow\)\(Na_2SO_3\)+\(H_2O\)
ban đầu: 0,01 0,075 (mol)
phản ứng: 0,01 0,005 0,005 (mol)
dư: 0 0,07 0 (mol)
m\(_{Na_2SO_3}\)=0,005.126=0,63(g)