Cho a gam hỗn hợp gồm 2 kim loại A và B (chưa rõ hoá trị) tác dụng hết với dd HCl (cả A và B đều phản ứng). Sau khi phản ứng kết thúc, người ta chỉ thu được 67 gam muối và 8,96lít H2 (ĐKTC).
a. Viết các phương trình hoá học ?
b. Tính a ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1:
a) PTHH: \(2A+2xHCl\rightarrow2ACl_x+xH_2\uparrow\)
\(2B+2yHCl\rightarrow2BCl_y+yH_2\uparrow\)
b) Ta có: \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\) \(\Rightarrow m_{H_2}=0,4\cdot2=0,8\left(g\right)\)
Theo các PTHH: \(n_{HCl}=2n_{H_2}=0,8\left(mol\right)\) \(\Rightarrow m_{HCl}=0,8\cdot36,5=29,2\left(g\right)\)
Bảo toàn khối lượng: \(a=m_{KL}=m_{muối}+m_{H_2}-m_{HCl}=38,6\left(g\right)\)

a) gọi hóa trị của kim loại A là x , của kim loại B là y
PTHH:
2A + 2xHCl \(\rightarrow\) 2AClx + xH2 (1)
2B + 2yHCl \(\rightarrow\) 2BCly + yH2 (2)
b) nH2 = V/22,4 = 8,96/22,4 = 0,4(mol) => mH2 = 0,4 x 2 = 0,8(g)
Theo PT(1)(2) => nHCl = 2nH2 = 2 . 0,4 = 0,8(mol)
=> mHCl = 0,8 x 36,5 =29,2(g)
Theo ĐLBTKL :
mhỗn hợp 2 kim loại + mHCl = m2 muối + mH2
=> a + 29,2 = 67 + 0,8 => a =38,6(g)

Do A và B đều tác dụng hết với dd HCl nên có thể viết được phương trình phản ứng :
2A + 2xHCl\(\rightarrow\)2 AClx +x H2;
2B+2yHCl\(\rightarrow\) 2BCly+yH2;
- Vì phản ứng xảy ra hết:
-nH2=\(\dfrac{8.96}{22.4}=0.4\left(mol\right)\) \(\Leftrightarrow\) mH2=0,8(g)
-Bảo toàn nguyên tố H: nH(H2)=nH(HCl)=2nH2=0.8(mol)
\(\Leftrightarrow\) nHCl=0.8(mol)
-mHCl=0,8.36,5=29,2(g)
- Áp dụng định luật bảo toàn khối lượng ta có:
a+mHCl=mMuối +mH2 => a=38.6(g)
Vậy ...
Gọi x, y lần lượt là hóa trị của kim loại A, B.
a. PTHH:
\(2A+2xHCl\rightarrow2ACl_x+xH_2\)
\(2B+2yHCl\rightarrow2BCl_y+yH_2\)
b. \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
\(\Rightarrow m_{H_2}=0,4.2=0,8\left(g\right)\)
Theo PT ta có: \(n_{HCl}=2.n_{H_2}=2.0,4=0,8\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,8.36,5=29,2\left(g\right)\)
Áp dụng ĐL BTKL ta có:
\(m_A+m_{HCl}=m_{muoi}+m_{H_2}\)
\(\Rightarrow m_A=m_{muoi}+m_{H_2}-m_{HCl}\)
\(\Rightarrow_A=67+0,8-29,2=38,6\left(g\right)\)

a) Gọi x,y lần lượt là hóa trị của kim loại A, B
Pt: 2A + 2xHCl --> 2AClx + xH2
......2B + 2yHCl --> 2BCly + yH2
b) nH2 = \(\dfrac{8,96}{22,4}=0,4\) mol
mH2 = 0,4 . 2 = 0,8 (g)
Từ pt: => nHCl =2nH2 = 2. 0,4 = 0,8 mol
=> mHCl = 0,8 . 36,5 = 29,2 (g)
Áp dụng ĐLBTKL, ta có:
mhh + mHCl = mmuối + mH2
=> mhh = mmuối + mH2 - mHCl
Hay: a = 67 + 0,8 - 29,2 = 38,6 (g)

1.
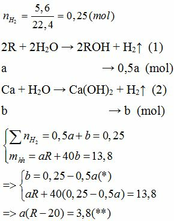
Vì b > 0, từ (*) => a < 0,25/0,5 = 0,5 thế vào (**)
=> R – 20 > 7,6
=> R > 27,6 (***)
Khi cho 8,58 gam R tác dụng với lượng dư HCl thì lượng H2 thoát ra lớn hơn 2,24 (lít)
2R + 2HCl → 2RCl + H2↑ (3)
Theo PTHH (3):
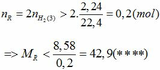
Từ (***) và (****) => 27, 6 < MR < 42,9
Vậy MR = 39 (K) thỏa mãn
2.
Ta có:
=> nKOH = nK = 0,2 (mol)
nCa(OH)2 = nCa = 0,15 (mol)
∑ nOH- = nKOH + 2nCa(OH)2 = 0,2 + 2.0,15 = 0,5 (mol)
Khi cho hỗn hợp Z ( N2, CO2) vào hỗn hợp Y chỉ có CO2 phản ứng
CO2 + OH- → HCO3- (3)
CO2 + 2OH- → CO32- + H2O (4)
CO32- + Ca2+ → CaCO3↓ (5)
nCaCO3 = 8,5/100 = 0,085 (mol) => nCO32-(5) = nCaCO3 = 0,085 (mol)
Ta thấy nCaCO3 < nCa2+ => phương trình (5) Ca2+ dư, CO32- phản ứng hết
TH1: CO2 tác dụng với OH- chỉ xảy ra phản ứng (4)
Theo (4) => nCO2 = nCO32-(4) = nCaCO3 = 0,085 (mol)
=> VCO2(đktc) = 0,085.22,4 = 1,904 (lít)
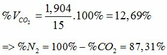
TH2: CO2 tác dụng với OH- xảy ra cả phương trình (3) và (4)
Theo (4): nCO2 = nCO32- = 0,085 (mol)
nOH- (4) = 2nCO32- = 2. 0,085 = 0,17 (mol)
=> nOH- (3)= ∑ nOH- - nOH-(4) = 0,5 – 0,17 = 0,33 (mol)
Theo PTHH (3): nCO2(3) = nOH- = 0,33 (mol)
=> ∑ nCO2(3+4) = 0,085 + 0,33 = 0,415 (mol)
=> VCO2 (ĐKTC) = 0,415.22,4 = 9,296 (lít)
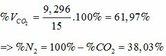

\(n_{H_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Ag}=y\left(mol\right)\end{matrix}\right.\Rightarrow27x+108y=4,2\left(1\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,1 0,05 0,15
\(\Rightarrow m_{Al}=0,1\cdot27=2,7g\)
\(\Rightarrow m_{Ag}=4,2-2,7=1,5g\)
a)\(\%m_{Al}=\dfrac{2,7}{4,2}\cdot100\%=64,28\%\)
\(\%m_{Ag}=100\%-64,28\%=35,72\%\)
b)\(m_{muối}=0,05\cdot342=17,1g\)

Đáp án D
Nhận thấy ở hai thí nghiệm có lượng kim loại tham gia phản ứng như nhau, lượng HCl sử dụng lớn hơn lượng HCl sử dụng ở thí nghiệm 1 nhưng lượng H2 ở hai thí nghiệm thu được như nhau.
Do đó ở thí nghiệm 2 HCl phản ứng dư, thí nghiệm 1 có HCl phản ứng đủ hoặc dư.
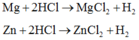
Có
![]()
Quan sát 4 đáp án nhận thấy chỉ có giá trị 0,3 là phù hợp.
Gọi x,y lần lượt là số mol của A,B
nH2 = \(\dfrac{8,96}{22,4}=0,4\) mol
Pt: 2A + 2xHCl --> 2AClx + xH2
.....2B + 2yHCl --> 2BCly + yH2
Theo pt ta có: nHCl = 2nH2 = 2 . 0,4 = 0,8 mol
=> mHCl = 0,8 . 36,5 = 29,2 (g)
Áp dụng ĐLBTKL, ta có:
a = mmuối khan + mH2 - mHCl = 67 + (0,4 . 2) - 29,2 = 38,6 (g)