cho 11,2g Fe tác dụng với đơn chất halogen, sau phản ứng thu được 32,5g muối sắt halogenua. Xác định tên gọi của đơn chất halogen.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Phương trình hóa học của phản ứng: Gọi X là kí hiệu nguyên tử khối của halogen.
Mg + X2 → MgX2
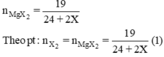
2Al + 3X2 → 2AlX3.
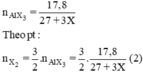
Cho (1) = (2). Giải ta rút ra X = 35,5 (Cl)
b) Thay X = 35,5 vào (1) ⇒ nCl2 = 0,2 mol ⇒ mCl2 = 14,2g.

KH nguyến tố halogen là X , đặt a là số mol ptu X2
ptpu:
Mg + X2 ----> MgX2
mol : a−−>a
2Al + 3X2 ---> 2AlX3
mol: a−−−>\(\frac{2a}{3}\)
từ pt => (24 + 2X).a =19 => a=\(\frac{19}{24+2X}\)
(27 + 3X).1,5a =17,8 => a= \(\frac{17,8.3}{\left(27+3X\right).2}\) =>X=35,5
![]()

a) Phương trình hóa học của phản ứng: Gọi X là kí hiệu nguyên tử khối của halogen.
2Al + 3X2 \(\rightarrow\) 2AlX3.
nAlX3 = 17,8/(27+3X).
nX2 = 3.17,8/ 2(27+3X). (1)
Mg + X2 \(\rightarrow\)MgX2
nMgX2 = 19 /(24 + 2X).
nX2 = 19/ (24+ 2X) (2).
Cho (1) = (2). Giải ta rút ra X = 35,5 (Cl)
b) mCl2 = 14,2g.
a) Phương trình hóa học của phản ứng: Gọi X là kí hiệu nguyên tử khối của halogen.
2Al + 3X2 →→ 2AlX3.
nAlX3 = 17,8/(27+3X).
nX2 = 3.17,8/ 2(27+3X). (1)
Mg + X2 →→MgX2
nMgX2 = 19 /(24 + 2X).
nX2 = 19/ (24+ 2X) (2).
Cho (1) = (2). Giải ta rút ra X = 35,5 (Cl)
b) mCl2 = 14,2g.

Mg+X2---->MgX2
n Mg=12/24=0,5(mol)
n MgX2=\(\frac{47,5}{24+2X}\left(mol\right)\)
Theo pthh
n Mg=n MgX2
-->\(\frac{47,5}{24+2X}=0,5\Leftrightarrow47,5=12+X\)
-->X=35,5(Cl)
Vậy .......

\(Mg+2HCl\rightarrow MgCl_2+H_2\)
x______2x_______x_____ x
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
y____2y______y_________ y
\(\left\{{}\begin{matrix}24x+56y=8\\x+y=\frac{2,28}{22,4}=0,2\end{matrix}\right.\rightarrow x=y=0,1\)
\(\%m_{Mg}=\frac{0,1.24}{8}.100\%=30\%,\%m_{Fe}=100\%-30\%=70\%\)
\(n_{HC}=2.0,1+2.0,1=0,4\left(mol\right)\)
\(m_{dd_{HCl}}=\frac{0,4.36,5}{14,6\%}=100\left(g\right)\)
\(C\%_{MgCl2}=\frac{0,1.\left(24+71\right)}{8+100-0,1.2}.100\%=8,83\%\)
\(C\%_{FeCl_2}=\frac{0,1.\left(56+71\right)}{8+100-0,2.2}.100\%=11,8\%\)
\(Mg+X_2\rightarrow MgX_2\)
\(n_{Mg}=\frac{1,2}{24}=0,05\left(mol\right)\)
\(n_{MgX2}=\frac{4,75}{24+2X}\)
Ta có nMg=nMgX2
\(\Leftrightarrow0,05=\frac{4,75}{24+2X}\)
\(\rightarrow X=35,5\left(Cl\right)\)

Bảo toàn khối lượng ta có: $m_{R}=2,4(g)$$R+X_2\rightarrow RX_2$
Ta có: $\frac{2,4}{R}=\frac{4,26}{2X}$
Lập bảng biện luận thông qua halogen tìm được X và R lần lượt là Cl và Ca

Gọi tên của đơn chất halogen là X
\(Fe+3X\underrightarrow{t^o}FeX_3\)
ta có :\(\dfrac{56}{11,2}=\dfrac{56+3X}{32,5}\) => X = 35,5
Vậy X là Clo ( Cl )
nFe = 0,2 mol
Fe + 3M → FeM3
0,2..................0,2
⇒ \(\dfrac{32,5}{56+3M}\) = 0,2
⇔ 32,5 = 11,2 + 0,6M
⇔ 21,3 = 0,6M
⇔ M = 35,5 (Cl)
Vậy M là clo