trong phòng thí nghiệm, người ta dùng CO để khử Fe3O4 và dùng H2 để khử Fe2O3 ở nhiệt độ cao. Biết rằng trong mỗi phản ứng trên đều có 0,1 mol mỗi loại oxit sắt tham gia phản ứng
a) viết phương trình hóa học của phản ứng đã xảy ra
b) Tính số lít khí CO và H2 ở đktc cần dùng cho mỗi phản ứng trên
c) Tính số gam sắt thu được trong mỗi phản ứng hóa học


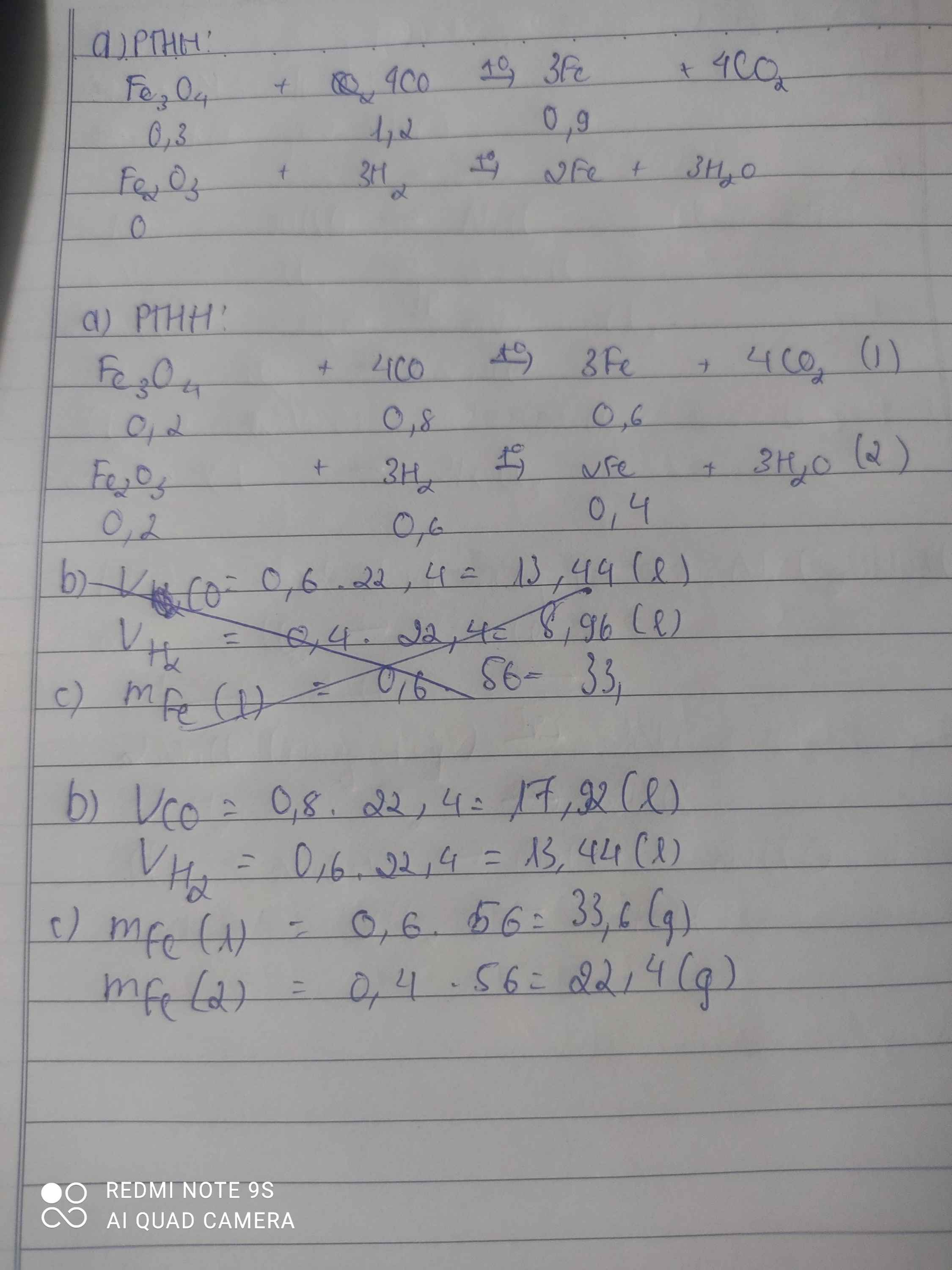
pt: Fe3O4+4CO--->3Fe+4CO2(1)
Fe2O3+3H2--->2Fe+3H2O(2)
b)Theo pt(1): nCO=4nFe3O4=4.0,1=0,4(mol)
=>VCO=0,4.22,4=8,96(l)
Theo pt(2): nH2=3nFe2O3=3.0,1=0,3(mol)
=>VH2=0,3.22,4=6,72(l)
c) Theo pt(1): nFe=3nfe3O4=3.0,1=0,3(mol)
=>mFe(1)=0,3.56=16,8(g)
Theo pt (2): nFe=2nFe2O3=2.0,1=0,2(mol)
=>mFe(2)=0,2.56=11,2(g)
tóm tắt:
nFe3O4 = nFe2O3 = 0,1mol
a) viết PTHH
b)VCO = ? (l) ; VH2 = ? (l)
c) mFe = ? g
giải
a)PTHH : 4CO + Fe3O4 → 4CO2 + 3Fe (1)
0,4mol←0,1 mol →0,3 mol
3H2 + Fe2O3 →3H2O + 2Fe (2)
0,3mol←0,1mol → 0,2mol
b)⇒VCO = 0,4 . 22,4 = 8,96 g;
⇒VH2 = 0,3 . 22,4 = 6,72 g
c) mFe(1) = 0,3 . 56 = 16,8 g
mFe(2) = 0,2 . 56 = 11,2 g