Nêu các thí dụ chứng minh rằng oxi là một đơn chất phi kim rất hoạt động. Trên cơ sở đó hãy so sánh với tính chất hóa học cơ bản của đơn chất hiđro. Viết phương trình minh họa.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


C + O2 → CO2
2Zn + O2 → 2ZnO ( to )
S + O2 → SO2
⇒ Oxi hoạt động mạnh hơn hiđrô vì một số chất nếu muốn tác dụng với hiđrô còn điều kiện rất khắc nghiệt khó xảy ra ( C tác dụng với cần nhiệt độ rất cao mới xảy ra phản ứng)hoặc không phản ứng ( hiđrô không tác dụng với kim lọai) còn oxi chỉ cần nhiệt độ và chất xúc tác

Oxi có độ âm điện lớn.Khi phản ứng , nguyên tử Oxi dễ dàng nhận thêm 2 electron. Do vậy,oxi là nguyên tố phi kim hoạt động,có tính oxi hóa mạnh.
- Oxi hóa trực tiếp với nhiều kim loại (trừ Pt,Au,...) thành oxi bazo hoặc oxit lưỡng tính.
\(2Mg + O_2 \xrightarrow{t^o} 2MgO\\ 3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4\)
- Khi đun nóng oxi hóa được nhiều phi kim (trừ halogen) thành oxi axit,oxit trung tính,...
\(C + O_2 \xrightarrow{t^o} CO_2\\ S + O_2 \xrightarrow{t^o} SO_2\)
- Oxi hóa với các hợp chất khác :
\(CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O\\ 2CO + O_2 \xrightarrow{t^o} 2CO_2\)

Ở nhiệt độ thường các phi kim, kim loại phản chậm với oxi, nhưng ở nhiệt độ cao các phản ứng xảy ra nhanh và mãnh liệt hơn. Ví dụ
- Lưu huỳnh cháy trong oxi tạo khí lưu huỳnh đioxit SO2
- Photpho cháy mạnh trong khí oxi với ngọn lửa màu sáng chói,…
- Sắt cháy mạnh trong oxi, sáng chói, không khói,…

Oxi là một đơn chất rất hoạt động (đặc biệt ở nhiệt độ cao), ví dụ:
3Fe + 2O2 → Fe3O4.
S + O2 → SO2.


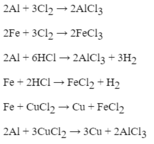
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
\(S+O_2\underrightarrow{t^o}SO_2\)
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
C + O2 → CO2
2Zn + O2 → 2ZnO ( to )
S + O2 → SO2
⇒ Oxi hoạt động mạnh hơn hiđrô vì một số chất nếu muốn tác dụng với hiđrô còn điều kiện rất khắc nghiệt khó xảy ra ( C tác dụng với cần nhiệt độ rất cao mới xảy ra phản ứng)hoặc không phản ứng ( hiđrô không tác dụng với kim lọai) còn oxi chỉ cần nhiệt độ và chất xúc tác