Bài 8: Hỗn hợp khí gồm etan và protan có tỉ khối so với H2 là 20,25, được nung trong bình với xúc tác thích hợp để thực hiện phản ánh tách hidro. Sau 1 thời gian thu được hỗn hợp khí có tỉ khối so với H2 là 16,2 gồm các ankan, anken, H2. Tính hiệu suất của phản ứng tách hidro (giả sử tốc độ phản ứng của các etan và protan là như nhau)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : C
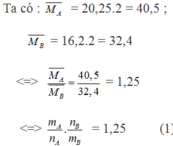
Áp dụng định luật bảo toàn khối lượng ta có: mA = mB
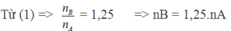
Giả sử ban đầu có 1 mol hỗn hợp A => nB = 1,25.1 = 1,25 mol
Trong phản ứng đề hidro hóa: số mol hỗn hợp sau phản ứng tăng, số mol tăng của hỗn hợp B so với hỗn hợp A chính là số mol các chất phản ứng
=> H = (1,25-1) .100% = 25%

Đáp án C
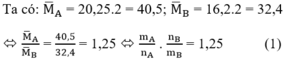
Áp dụng định luật bảo toàn khối lượng ta có: mA = mB
![]()
Giả sử ban đầu có 1 mol hỗn hợp A => nB = 1,25.1 = 1,25 mol
Trong phản ứng đề hidro hóa: số mol hỗn hợp khí sau phản ứng tăng, số mol tăng của hỗn hợp B so với hỗn hợp A chính là số mol các chất phản ứng.
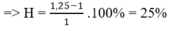

Hoàn toàn tương tự bài toán trước. Có thể tự chọn lượng chất rồi bảo toàn khối lượng cho phản ứng, hoặc một cách nhanh hơn là áp dụng công thức:

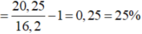
Vậy đáp án đúng là A

\(\overline{M}=24\cdot2=48\)
\(\dfrac{n_{SO_2}}{n_{O_2}}=\dfrac{64-48}{48-32}=1\)
\(n_{hh}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(\Rightarrow n_{SO_2}=n_{O_2}=0.15\left(mol\right)\)
\(2SO_2+O_2\underrightarrow{^{t^0,V_2O_5}}2SO_3\)
Bđ:0.15....0.15
Pư: x..........0.5x......x
KT: 0.15-x..0.15-0.5x..x
\(n_{hh}=0.15-x+0.15-0.5x+x=0.3-0.5x\left(mol\right)\)
\(m=\left(0.15-x\right)\cdot64+\left(0.15-0.5x\right)\cdot32+80x=\left(0.3-0.5x\right)\cdot2\cdot26\)
\(\Rightarrow x=\dfrac{3}{65}\)
\(H\%=\dfrac{\dfrac{3}{65}}{0.15}\cdot100\%=30.7\%\)

Coi n X = 1(mol)
Gọi n H2 = a(mol) ; n N2 = b(mol)
Ta có :
a + b = 1
2a + 28b = 3,6.2 = 7,2
=> a = 0,8 ; b = 0,2
3H2 + N2 \(\xrightarrow{t^o,xt}\)2 NH3
3a........a..............2a........(mol)
Vì n H2 / 3 > n N2 / 1 nên hiệu suất tinh theo số mol N2
Gọi hiệu suất là a => n N2 pư = a(mol)
m Y = m X = 7,2
=> n Y = 7,2/(4,2826.2) = 0,84(mol)
Sau phản ứng, Y gồm :
H2 : 0,8 - 3a
N2 : 0,2 - a
NH3 : 2a
=> n Y = 0,8 - 3a + 0,2 -a + 2a = 0,84
=> a = 0,08 = 8%

Đáp án B
Hỗn hợp ban đầu chứa N 2 : 0 , 2 H 2 : 0 , 8
→ Hiệu suất tính theo N2.
nsau = 3,6/4 = 0,9 → N2 phản ứng = 0,05 → H = 25%


Giả sử hỗn hợp có 1 mol
M(hỗn hợp) = 40.5g/mol -> m(hỗn hợp)=40.5g
Sau phản ứng M hỗn hợp = 32.4g/mol
m hỗn hợp không đổi = 40.5g
-> nHỗn hợp = 40.5/32.4=1.25 mol
1 mol - 1.25 mol
0.25 mol tạo ra là do dehidro hoá tạo ra hirdo
Ankan -> Anken + Hidro
-> nH2 = nAnkan bị dehidro hoá
-> H=nAnkan bị dehiro hoá/ nAnkan ban đầu = 0.25/1=0.25=25%
Ta có: \(m_A=m_B\)
\(\Leftrightarrow40,5.n_A=32,4.n_B\)
\(\dfrac{n_B}{n_A}=\dfrac{4}{5}\)
\(C_nH_{2n+n}\rightarrow CnH_{2n}+H_2\)
\(\begin{matrix}BĐ:&a&&\\PƯ:&x&x&\\Sau:&a-x&x&x\end{matrix}\)
Ta có: \(\dfrac{a-x+x+x}{a}=\dfrac{5}{4}\)
\(\Leftrightarrow\dfrac{x}{a}=\dfrac{1}{4}\)
\(H\%=25\%\)