Dùng 150 gam quặng pirit chưá 20% chất trơ điều chế H2SO4 . Đem toàn bộ lượng axit điều chế được hòa tan vừa đủ m gam Fe2O3 . Tất cả phản ứng xảy ra hoàn toàn , hãy
a. Tính khối lượng H2SO4 điều chế được ?
b. Tính m ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(m_{FeS_2}=45-45.20:100=36kg\\ FeS_2\rightarrow H_2SO_4\\ \Rightarrow2n_{FeS_2}=n_{H_2SO_4\left(lt\right)}\\ \Rightarrow2\cdot\dfrac{36}{120}=\dfrac{m_{H_2SO_4\left(lt\right)}}{98}\\ \Rightarrow m_{H_2SO_4\left(lt\right)}=58,8kg\\ m_{H_2SO_4\left(tt\right)}=58,8.60:100=35,28kg\\ m_{H_2SO_4,70\%}=35,28.100:70=50,4kg\)

Đáp án A.
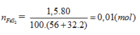
FeS2 → 2H2SO4 (Bảo toàn S)
0,01 → 0,02 (mol)
Do hiệu suất là 80%
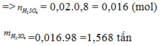

\(n_{Fe_2O_3}=\dfrac{48}{160}=0,3(mol)\\ PTHH:Fe_2O_3+3H_2SO_4\to Fe_2(SO_4)_3+3H_2O\\ \Rightarrow n_{H_2SO_4}=3n_{Fe_2O_3}=0,9(mol)\\ \Rightarrow m_{dd_{H_2SO_4}}=\dfrac{0,9.98}{19,6\%}=450(g)\)
vì trong quặng pirit chứa 20% chất trơ nên FeS2 chiếm 80% trong quặng pirit nên ta có:
m FeS2 = \(\dfrac{150\cdot80}{100}=120\left(g\right)\)
PTHH
4FeS2 + 11O2 -to-> 2Fe2O3 + 8SO2
2SO2 + O2 -to- V2O5 -> 2SO3
SO3 + H2O -> H2SO4
Từ ba phương trình hóa học trên ta có chuỗi phản ứng:
FeS2 -> 2 SO2 -> 2 SO2 -> 2 H2SO4
1mol ->2 mol ->2 mol ->2mol
120g------------------------>196g
120g------------------------->196g
vậy điều chế được 196 g H2SO4
n H2SO4 = \(\dfrac{m}{M}=\dfrac{196}{98}=2\left(mol\right)\)
Fe2O3 + 3H2SO4 -> Fe2(SO4)3 + 3H2O
1 mol---3mol---------1mol-----------3mol
2/3 mol <-2mol
mFe2O3 = n*M = \(\dfrac{2}{3}\cdot160\approx106,7\left(g\right)\)
sao tỉ lệ của H2SO4 lại là 2