hòa tan a gam hỗn hợp kim loại R hóa trị II vào dd HCl thu được dd X.để trung hòa vừa hết X cần 64 gam NaOH 12,5%.Phản ứng tạo dung dịch Y chứa 4,68% khối lượng NaCl và 13,3% khối lượng RCl2.Cho tiếp lượng dư NaOH vào Y lọc kết tủa tạo thành đem nung đến khối lượng không đổi thu đươc 14g chất rắn .Xác định R
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


R2O3+6HCl->2RCl3+3H2O
nHCl=0.3(mol)
->nR=0.05(mol)->MR2O3=8:0.05=160(g/mol)
->MR=(160-16*3):2=56(g/mol)->M là Fe
Bài 2
nH2=0.3(mol)
2X+2nHCl->2XCln+nH2(n là hóa trị của kim loại)
nX=0.6:n
+) n=1->MX=9(g/mol)->loại
+)n=2->MX=18(g/mol)->loại
+)n=3->MX=27(g/mol)->X là Al
Bài cuối bạn viết phương trình,chỉ phương trình Al+H2SO4 mới tạo khí thôi,vậy bạn tính được khối lượng nhôm,từ đó tính ra khối lượng nhôm oxit nhé,vì đang vội nên mình không giải giúp bạn được
Bài 3
nH2 = \(\frac{13,44}{22,4}\) = 0,6 mol
2Al + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2 \(\uparrow\) (1)
0,4 <---- 0,6 <-------- 0,2 <------ 0,6 (mol)
Al2O3 + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2O (2)
a) %mAl = \(\frac{0,4.27}{31,2}\) . 100% = 34,62%
%mAl2O3 = 65,38%
b) nAl2O3 = \(\frac{31,2-0,4.27}{102}\) = 0,2 (mol) = nAl2(SO4)3
Theo pt(2) nH2SO4 = 3nAl2O3 = 0,6 (mol)
m dd H2SO4 = \(\frac{\left(0,6+0,6\right)98}{20\%}\) = 588(g)
c) m dd spư = 31,2 + 588 - 0,6 . 2 = 618 (g)
C%(Al2(SO4)3) = \(\frac{\left(0,2+0,2\right)342}{618}\) . 100% = 22,14%

\(n_{H_2SO_4}=\dfrac{78,4.20}{100.98}=0,16\left(mol\right)\)
PTHH: X + H2SO4 --> XSO4 + H2
____0,16<--0,16--->0,16-->0,16
=> 0,16.MX + 78,4 - 0,16.2 = 88,48
=> MX = 65 (g/mol)
=> X là Zn

Gọi nM = x; nA = y; nB = z. M + 2H20 --> M(0H)2 + H2
x...........................x............
A + H20 --> A0H + 1/2H2 y.........................y........y/2
B + H20 --> B0H + 1/2H2 z......................z........z/2
Tổng n OH- là : 2x + y + z
1/2 dung dịch C thì chứa x + y/2 + z/2 mol 0H- chính bằng nH2 = 0,24 mol Ta có : H(+) + 0H(-) --->H20
0,24......0,24
=> tổng nH+ phải dùng là 0,24 mol (1)
mà số phân tử gam HCl nhiều gấp 4 lần số phân tử gam H2SO4. tức nHCl = 4nH2S04 nhưng trong phân tử H2S04 có 2H+
=> nH+ trong HCl = 2 nH+ trong H2S04 (2)
từ 1 và 2 => n H+ trong HCl =n Cl- = nHCl = 0,16 n H+ trong H2S04 = 2nS04(2-) =0,08
m muối = m kim loại + m Cl- + m S04(2-)
= 17,88/2 + 0,08*35,5 + 98*(0,08/2)
= 18,46 g
=> Đáp án D

\(A: M, Fe\\ A+H_2SO_4 \to ASO_4+H_2\\ n_{H_2}=\frac{5,376}{22,4}=0,24(mol)\\ n_A=n_{H_2}=0,24(mol)\\ M_A=\frac{12}{0,24}=50(g/mol)\\ A+2HCl \to ACl_2+H_2\\ n_A=\frac{1}{2}.n_{HCl}=\frac{1}{2}.0,24=0,12(mol)\\ M_A=\frac{3,6}{0,12}=30(g/mol)\\ 30< A <50\\ a/ \\\Rightarrow A: Ca\\ b/ \\ Fe+H_2SO_4 \to FeSO_4+H_2\\ Ca+H_2SO_4 \to CaSO_4+H_2\\ n_{Fe}=a(mol)\\ n_{Ca}=b(mol)\\ m_{hh}=56a+40b=12(1)\\ n_{H_2}=a+b=0,24(mol)(2)\\ (1)(2)\\ a=0,15\\ b=0,09\\ \%m_{Fe}=\frac{0,15.56}{12}.100\%=70\%\\ \%m_{Ca}=100\%-70\%=30\% \)

\(n_{HCl}=\dfrac{14,6}{36,5}=0,4\left(mol\right)\)
\(PTHH:R+2HCl\rightarrow RCl_2+H_2\uparrow\\ Mol:0,2\leftarrow0,4\rightarrow0,2\rightarrow0,2\)
=> MR = \(\dfrac{13}{0,2}=65\left(\dfrac{g}{mol}\right)\)
=> R là Zn
=> \(\left\{{}\begin{matrix}V_{H_2}=0,2.22,4=4,48\left(l\right)\\m_{ZnCl_2}=0,2.136=27,2\left(g\right)\end{matrix}\right.\)
nHCL = 14,6 : 36,5 = 0,4 (MOL)
pthh : 2R + 2xHCl ---> 2RClx + xH2
0,4x<--0,4 (mol)
MR = 13:0,4x = 32,5x(g/mol)
xét
x = 1 (KTM )
x= 2 (TM )
x = 3 (KTM )
x =4( KTM )
x= 5 (ktm )
x=6 (ktm)
x=7 (ktm )
=> R là zn

1/ nH2 = 0,39 mol; nHCl = 0,5 mol; nH2SO4 = 0,14 mol
nH+= 0,5 + 0,14.2 = 0,78 = 2nH2
=> axit phản ứng vừa đủ
Bảo toàn khối lượng: mkim loại + mHCl + mH2SO4 = mmuối khan + mH2
=> mmuối khan = 7,74 + 0,5.36,5 + 0,14.98 – 0,39.2 = 38,93 gam
2/ Đặt x, y là số mol Mg, Al
\(\left\{{}\begin{matrix}24x+27y=7,74\\x+\dfrac{3}{2}y=0,39\end{matrix}\right.\)
=> x=0,12 ; y=0,18
Để thu được kết tủa lớn nhất thì Al(OH)3 không bị tan trong NaOH
Dung dịch A : Mg2+ (0,12 mol) , Al3+ (0,18 mol)
\(Mg^{2+}+2OH^-\rightarrow Mg\left(OH\right)_2\)
\(Al^{3+}+3OH^-\rightarrow Al\left(OH\right)_3\)
=> \(n_{OH^-}=n_{NaOH}=0,12.2+0,18.3=0,78\left(mol\right)\)
=> \(V_{NaOH}=\dfrac{0,78}{2}=0,39\left(lít\right)\)

Đặt: \(\left\{{}\begin{matrix}x=n_{Fe}\left(mol\right)\\y=n_{Al}\left(mol\right)\end{matrix}\right.\)
\(\sum m_{hh}=11\left(g\right)\Rightarrow56x+27y=11\left(1\right)\)
\(PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\\ \left(mol\right)....x\rightarrow..2x........x......x\\ PTHH:2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\\ \left(mol\right)....y\rightarrow..3y.........y......1,5y\)
\(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\\ \Rightarrow x+1,5y=0,4\left(2\right)\)
\(\xrightarrow[\left(2\right)]{\left(1\right)}\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
a) \(\%m_{Fe}=\dfrac{56.0,1}{11}=51\%\)
\(\rightarrow\%m_{Al}=49\%\)
b) \(\sum m_{ctHCl}=\left(2.0,1+3.0,2\right).36,5=29,2\left(g\right)\)
\(m_{ddHCl}=\dfrac{29,2.100\%}{10\%}=292\left(g\right)\)
c) \(m_{H_2\uparrow}=\left(1.0,1+1,5.0,2\right).2=0,8\left(g\right)\)
\(m_{ddsaupu}=m_{hh}+m_{ddHCl}-m_{H_2\uparrow}=11+292-0,8=302,2\left(g\right)\)
\(C\%_{FeCl_2}=\dfrac{0,1.127}{302,2}.100=4,2\%\\ C\%_{AlCl_3}=\dfrac{0,2.133,5}{302,2}.100=8,8\%\)
Đặt: {x=nFe(mol)y=nAl(mol){x=nFe(mol)y=nAl(mol)
∑mhh=11(g)⇒56x+27y=11(1)∑mhh=11(g)⇒56x+27y=11(1)
PTHH:Fe+2HCl→FeCl2+H2↑(mol)....x→..2x........x......xPTHH:2Al+6HCl→2AlCl3+3H2↑(mol)....y→..3y.........y......1,5yPTHH:Fe+2HCl→FeCl2+H2↑(mol)....x→..2x........x......xPTHH:2Al+6HCl→2AlCl3+3H2↑(mol)....y→..3y.........y......1,5y
nH2=8,9622,4=0,4(mol)⇒x+1,5y=0,4(2)nH2=8,9622,4=0,4(mol)⇒x+1,5y=0,4(2)
(1)−→(2){x=0,1y=0,2→(2)(1){x=0,1y=0,2
a) %mFe=56.0,111=51%%mFe=56.0,111=51%
→%mAl=49%→%mAl=49%
b) ∑mctHCl=(2.0,1+3.0,2).36,5=29,2(g)∑mctHCl=(2.0,1+3.0,2).36,5=29,2(g)
mddHCl=29,2.100%10%=292(g)mddHCl=29,2.100%10%=292(g)
c) mH2↑=(1.0,1+1,5.0,2).2=0,8(g)mH2↑=(1.0,1+1,5.0,2).2=0,8(g)
mddsaupu=mhh+mddHCl−mH2↑=11+292−0,8=302,2(g)mddsaupu=mhh+mddHCl−mH2↑=11+292−0,8=302,2(g)
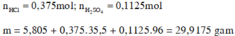
Cho e hỏi thêm câu b) tìm a va nồng độ % HCl đã dùng