Tìm số mol của 98g H2SO4 , 120g CUSO4 ( H=1, S=32, O=16, CU=64)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) mCuSO4= n * M = 0.5 * 160 = 80 (g)
b) mO= n * M = 1.75 * 16 = 28 (g)
c) mH2 = n * M = 2.5 * 2 = 5 (g)

a) mhh = 0,2.56+0,3.64 = 30,4 (g)
b) \(m_{H_2SO_4}=0,5.98=49\left(g\right)\)

\(n_{CuSO_4}=\dfrac{300}{160}=\dfrac{15}{8}\left(mol\right)\\ C_{MddCuSO_4}=\dfrac{\dfrac{15}{8}}{3}=0,625\left(M\right)\)

a)CuO+H2SO4--->CuSO4+H2O
b) Ta có
n CuO=3,2/80=0,04(mol)
Theo pthh
n H2SO4=n CuO=0,04(mol)
m dd H2SO4=\(\frac{0,04.98.100}{4,9}=80\left(g\right)\)
m dd sau pư=m CuO+m CuSO4=80+3,2=83,2(g)
n CuSO4=0,04(mol)
C% CuSO4=\(\frac{0,04.160}{83,2}.100\%=7,7\%\)

\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\\ n_{H_2SO_4}=n_{CuO}=\dfrac{19,6}{98}=0,2\left(mol\right)\\ \Rightarrow a=m_{CuO}=0,2\cdot80=16\left(g\right)\)
n H2SO4 = \(\dfrac{19,6}{2+32+16.4}=0,2mol\)
\(CuO+H_2SO_4->CuSO_4+H_2O\)
0,2..........0,2
m CuO = 0,2.(64+16)=16 g
Vậy a =16

\(n_{H_2}=\dfrac{12,395}{24,79}=0,5\left(mol\right)\)
=> \(n_{H_2SO_4}=0,5\left(mol\right)\)
=> \(m_{H_2SO_4}=0,5.98=49\left(g\right)\)
=> D
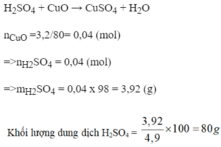
\(n_{H_2SO_4}=\dfrac{98}{98}=1\) (mol)
\(n_{CuSO_4}=\dfrac{120}{160}=0,75\) (mol)