Cho 2,05g hỗn hợp ba năm loại Cu, Al, Mg tác dụng với dung dịch H2SO4 loãng dư . Sau phản ứng thu được 1,568 lít khí ở điều kiện tiêu chuẩn và 0,64g một chất rắn không tan.
A. viết phương trình hoá học của phản ứng.
B. tính thành phần % khối lượng của mỗi kim loại trong hỗn hợp trên.
( lớp 9) mọi người giúp em với ạ em cần gấp, em cảm ơn.

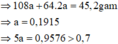
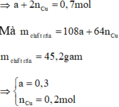
a) 2Al +3H2SO4 ➜ Al2(SO4)3 + 3H2
Mg + H2SO4 ➜ MgSO4 + H2
Cu đứng trước H trong dãy hoạt động hóa học của kim loại nên không phản ứng với axit H2SO4 loãng
b) nH2 = 1,568/22,4 = 0,07 mol
vì Cu khoomg phản ứng nên chất rắn còn lại là Cu ⇒ mCu = 0,64g
gọi x, y lần lượt là nAl, nMg
27x + 24y = 2,05 - 0,64
3/2x + y = 0,07
⇒ x = 0,03 mol hay nAl = 0,03 mol ⇒ mAl= 0,03.27 = 0,81g
%mCu = 0,64/2,05 = 31,22%
%mAl = 0,81/ 2,05 = 39,51%
%mMg = 29,27%