Hoà tan 16,25g một kim loại A hóa trị 2 vào 2 lít dung dịch axit 0.3M thì thấy kim loại hoà tan hoàn toàn. Sau phản ứng thu được 5,6 lít khí hidro và dung dịch B. Xác định\ tên và kim loại A và nồng độ mol các chất có trong dung dịch B.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\\ pthh:A+2HCl\rightarrow ACl_2+H_2\)
0,25 0,25
\(M_A=\dfrac{14}{0,25}=56\left(\dfrac{g}{mol}\right)\)
mà A hóa trị II
=> A là Fe
b)
\(n_{HCl}=\dfrac{14,6}{36,5}=0,4\left(mol\right)\\
pthh:Fe+2HCl\rightarrow FeCl_2+H_2\\
LTL:\dfrac{0,25}{1}>\dfrac{0,4}{2}\)
=> Fe dư
\(n_{Fe\left(p\text{ư}\right)}=n_{H_2}=n_{FeCl_2}=\dfrac{1}{2}n_{HCl}=0,2\left(mol\right)\\
m_{Fe\left(d\right)}=\left(0,25-0,2\right).56=2,8\left(g\right)\\
m_{FeCl_2}=0,2.127=25,4\left(g\right)\\
m_{H_2}=0,2.2=0,4\left(g\right)\)
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\\ pthh:A+2HCl\rightarrow ACl_2+H_2\)
0,25 0,25
\(M_A=\dfrac{14}{0,25}=56\left(\dfrac{g}{mol}\right)\)
mà A hóa trị II => A là Fe
\(n_{HCl}=\dfrac{14,6}{36,5}=0,4\left(mol\right)\\ pthh:Fe+2HCl\rightarrow FeCl_2+H_2\\ LTL:\dfrac{0,25}{1}>\dfrac{0,4}{2}\)
=> Fe dư
\(m_{FeCl_2}=n_{Fe\left(p\text{ư}\right)}=n_{H_2}=\dfrac{1}{2}n_{HCl}=0,2\left(mol\right)\\ m_{saup\text{ư}}=\left\{{}\begin{matrix}m_{Fe\left(d\right)}=\left(0,25-0,2\right).56=2,8\left(g\right)\\m_{FeCl_2}=0,2.127=25,4\left(g\right)\\m_{H_2}=0,2.2=0,4\left(g\right)\end{matrix}\right.=2,8+25,4+0,4=28,6\left(g\right)\)

a) Gọi Kl cần tìm là X có hóa trị chưa biết là n
2X+ 2nHCl = 2XCln+ nH2
Có nH2=0,25 mol --> nX= 0,5/n mol ---> mX=0,5.MX/n=16,25 --> MX=32,5n
n=1 => MX=32,5( không có Kl nào tm)
n=2 => MX=65( Zn)
b) nHCl= 2nH2=2.0,25=0,5 mol
==> VddHCl cần = 0,5/0,2=2,5 lit

\(a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ n_{Zn}=n_{ZnCl_2}=n_{H_2}=0,25\left(mol\right)\\ \Rightarrow m_{Zn}=0,25.65=16,25\left(g\right)\\ m_{ZnCl_2}=0,25.136=34\left(g\right)\\ b.FeO+H_2-^{t^o}\rightarrow Fe+H_2O\\ Tacó:n_{Fe}=n_{H_2}=0,25\left(mol\right)\\ \Rightarrow m_{Fe}=0,25.56=14\left(g\right)\)

\(n_{H_2}=\dfrac{5.6}{22.4}=0.25\left(mol\right)\)
\(M+2H_2O\rightarrow M\left(OH\right)_2+H_2\)
\(0.25................0.25............0.25\)
\(M_A=\dfrac{10}{0.25}=40\left(\dfrac{g}{mol}\right)\)
\(A:Ca\)
\(C_{M_{Ca\left(OH\right)_2}}=\dfrac{0.25}{0.5}=0.5\left(M\right)\)

PTHH: R + 2HCl ---> RCl2 + H2 (1)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(n_{HCl}=\dfrac{100}{1000}.5=0,5\left(mol\right)\)
Ta thấy: \(\dfrac{0,2}{1}< \dfrac{0,5}{2}\)
Vậy HCl dư.
Theo PT(1): \(n_R=n_{H_2}=0,2\left(mol\right)\)
=> \(M_R=\dfrac{4,8}{0,2}=24\left(g\right)\)
Vậy R là magie (Mg)
PT: Mg + 2HCl ---> MgCl2 + H2 (2)
Ta có: \(m_{dd_{MgCl_2}}=4,8+\dfrac{100}{1000}-0,2.2=4,5\left(lít\right)\)
Theo PT(2): \(n_{MgCl_2}=n_{H_2}=0,2\left(mol\right)\)
=> \(C_{M_{MgCl_2}}=\dfrac{0,2}{4,5}=\dfrac{2}{45}M\)
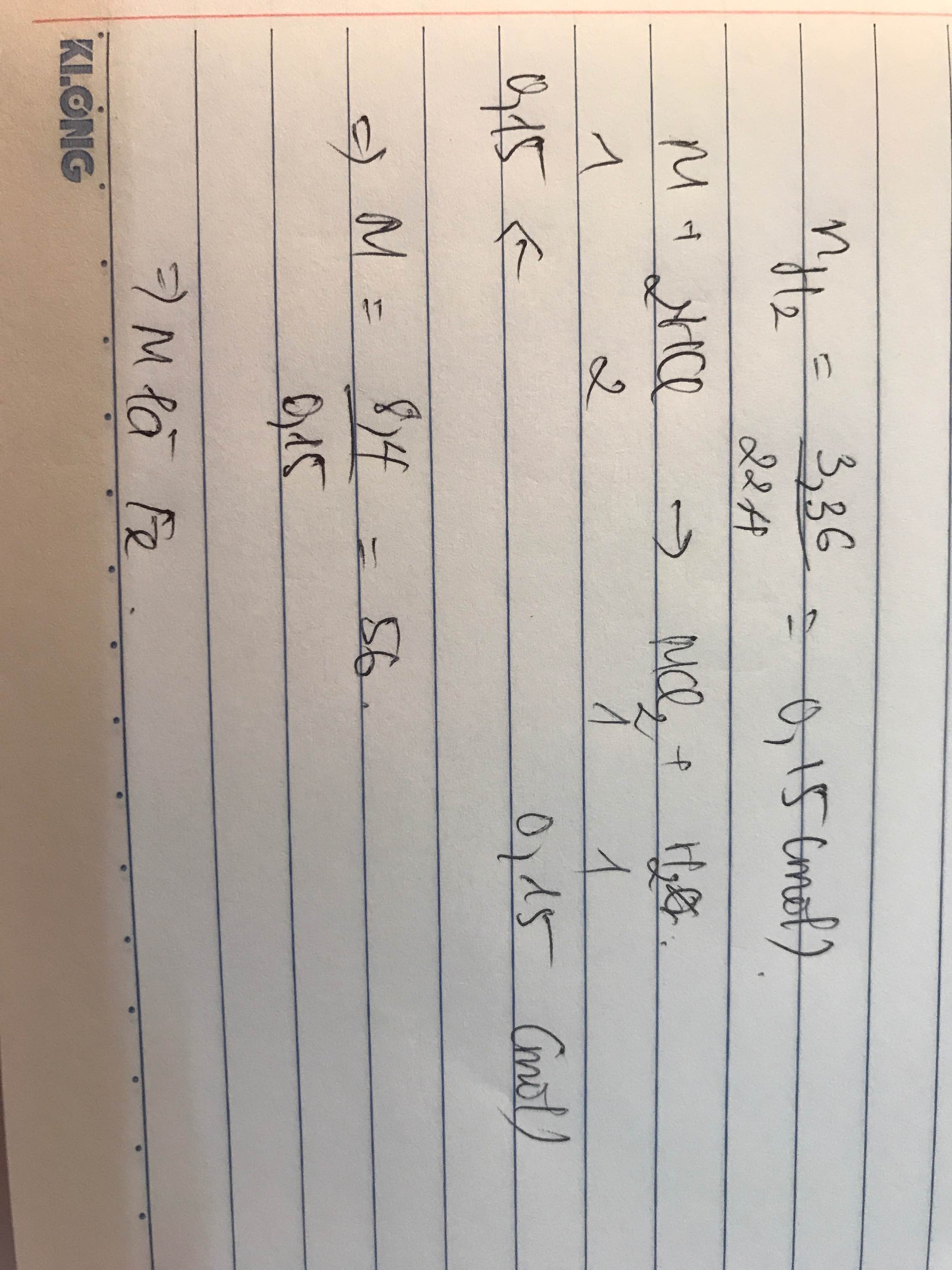
Ta thấy các axit mạnh có thể pư với kim loại để giải phóng ra khí H2 thì chỉ có hai axit là H2SO4(loãng) và HCl,nếu kim loại hóa trị hai này pư với một trong hai axit thì trong pư nH2=nkim loại hóa trị 2 đó
nkim loại hóa trị 2 đó=5,6:22,4=0,25(mol)
M của kim loại hóa trị hai đó là:16,25:0,25=65(Zn)
tên kim loại cần tìm là kẽm (Zn)
ta lại có n kim loại Zn pư=n muối Zn tạo thành=0,25(mol)
trong dd B sau pư sẽ có:muối của Zn và axit dư
Xét hai trường hợp:TH1: nếu axit là HCl thì nHCl pư=0,25\(\times\)2=0,5(mol)
(pư theo pthh:Zn+2HCl\(\rightarrow\)ZnCl2+H2)
nHCl dư=0,3\(\times\)2-0,5=0,1(mol) sau pư dd chứa HCl dư và ZnCl2
VddB=2(l) nên CM dd HCl dư=\(\dfrac{0,1}{2}\)=0,05(M)
CM dd ZnCl2=\(\dfrac{0,25}{2}\)=0,125(M)
TH2:axit là H2SO4(loãng)
pthh khi cho Zn tác dụng với H2SO4(loãng):
Zn+H2SO4\(\rightarrow\)ZnSO4+H2
nH2SO4 pư=nZn=0,25(mol)
nH2SO4 dư=2\(\times\)0,3-0,25=0,35(M)
sau pư dd B có H2SO4 dư và ZnSO4:
CM dd H2SO4 dư=\(\dfrac{0,35}{2}\)=0,175(M)
CM dd ZnSO4=\(\dfrac{0,25}{2}\)=0,125(M)