Cho các chất KMnO4 ; MnO2; HCl
a/ Nếu khối lượng các chất KMnO4 và MnO2 bằng nhau chọn chất nào để có thể điều chế được khí clo nhiều nhất
b/ Mết số mol của KMnO4 và MnO2 bằng nhau, thì chọn chất nào để điều chế được khí clo nhiều nhất
c/ Nếu muốn điều chế 1 thể tích clo nhất định thì chon KMnO4 hay MnO2 để tiết kiệm HCl

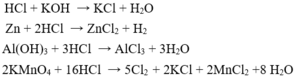
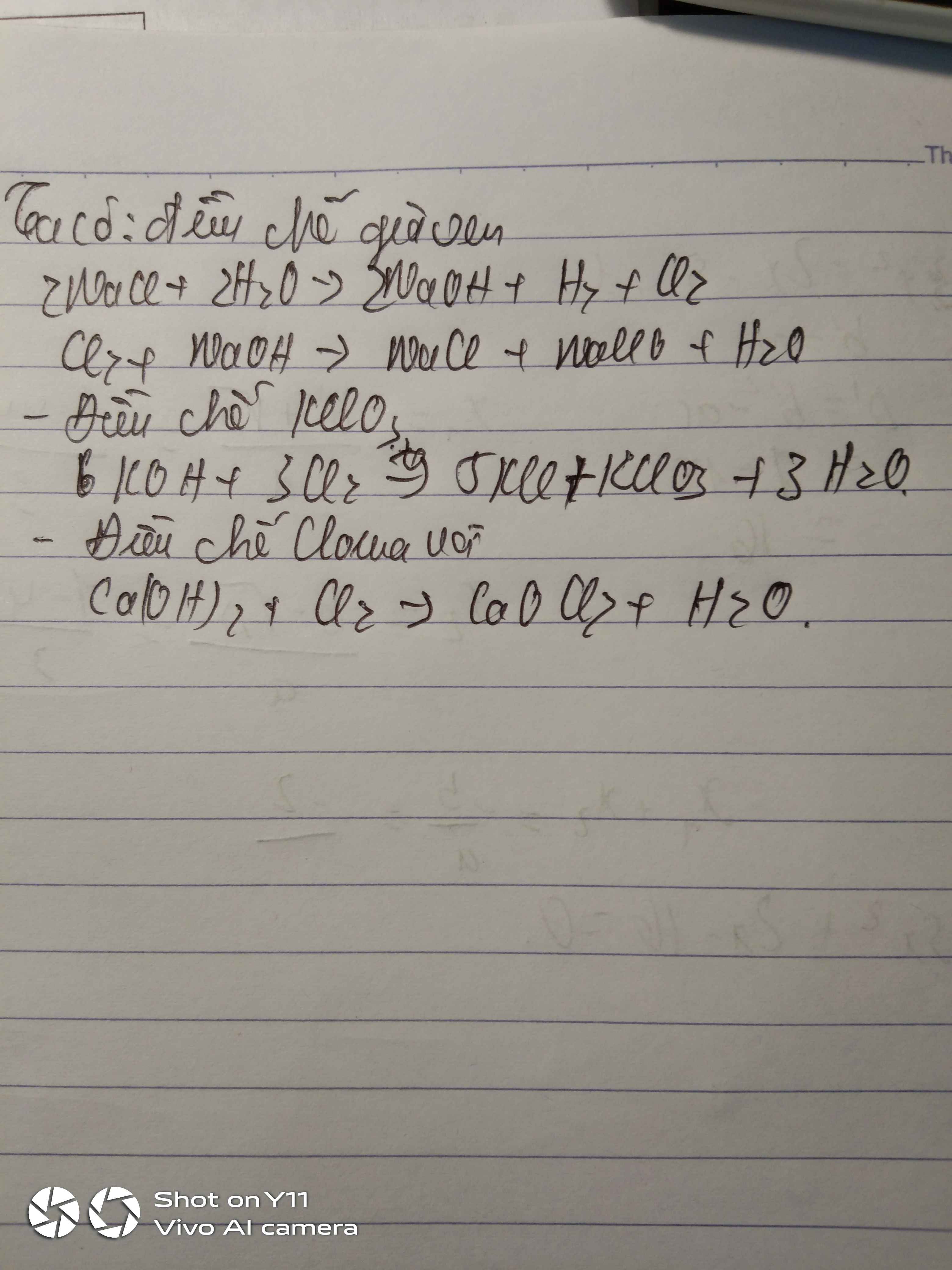
a) - Nếu dùng KMnO4:
2 KMNO4 + 16 HCl = 2 KCl + 2 MnCl2 + 8 H2O + 5 Cl2 (1)
- Nếu dùng MnO2:
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O (2)
Theo pt ta thấy (1) tạo ra 5Cl2 còn pư (2) chỉ tạo 1Cl2, chứng tỏ (1) tạo ra nhiều clo hơn (2).
b) giả sử số mol của KMnO4 và MnO2 là 0.2 mol
2 KMNO4 + 16 HCl = 2 KCl + 2 MnCl2 + 8 H2O + 5 Cl2 (1)
0.2.................................................................................0.5
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O (2)
0.2........................................0.2
Ta thấy số mol Cl2 ở (1) lớn hơn số mol Cl2 ở (2), suy ra pư (1) tạo nhiều clo hơn (2).
c) Từ (1) và (2) ta thấy:
Số mol HCl (1) lớn gấp 4 lần số mol HCl ở (2), suy ra ở pư (1) tiêu tốn HCl hơn pư (2).
Để thu được nhiều Clo hơn ta nên dùng pư (1) , còn muốn tiết kiệm HCl ta nên dùng MnO2.