cho 6,3 gam một kim loại X có hoá trị không đổi tác dụng hoàn toàn với 0,15 mol O2. Chất rắn thu được sau phản ứng đem hoà tan vào dung dịch HCL dư thấy thoát ra 1,12 lít khí H2 đktc. Xác định kim loại X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(2R+2nHCl\rightarrow2RCl_n+nH_2\)
.0,12/n...............0,12/n......0,06......
\(R_2O_n+2nHCl\rightarrow2RCl_n+nH_2O\)
.0,3/n......................................0,3....
\(n_{H_2O}=2n_{O_2}=0,3\left(mol\right)\)
Có : \(m=13,44=m_R+m_{R_2O_n}=\dfrac{0,12R}{n}+\dfrac{\left(2R+16n\right)0,3}{n}\)
\(\Rightarrow R=12n\)
=> R là Mg
\(n_{Al\left(I\right)}=\dfrac{3}{2}n_{H_2}=0,045\left(mol\right)\)
\(n_{Al\left(II\right)}=2n_{Al_2O_3}=\dfrac{2}{3}n_{H_2O}=\dfrac{2}{3}.2n_{O_2}=\dfrac{4}{3}n_{O_2}=\dfrac{1}{15}\left(mol\right)\)
\(\Rightarrow m_{Al}=m=3,015\left(g\right)\)

Chất rắn sau phản ứng hòa tan trong HCl thấy có khí thoát ra chứng ở có M dư
Số mol H2:
Theo phương trình (1)
Theo phương trình (3)
Tổng số mol M là
⇒ Giá trị thỏa mãn là n = 3, M = 27 M : Al

Đáp án B.
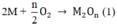
Chất rắn sau phản ứng hòa tan trong HCl thấy có khí thoát ra chứng ở có M dư
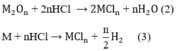
Số mol H2: 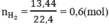
Theo phương trình (1)
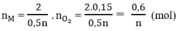
Theo phương trình (3)
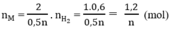
Tổng số mol M là 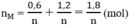
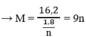
⇒ Giá trị thỏa mãn là n = 3, M = 27 M : Al

Đáp án C
Các phương trình phản ứng :
M tác dụng với O2: 4 M + 2 n O 2 → t 0 2 M n O n
Chất rắn sau phản ứng tác dụng với dung dịch HCl thu được khí H2, chứng tỏ chất rắn sau có M dư nên O2 hết - chất rắn sau gồm M dư và M2On :
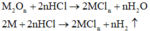
Tính toán:
Số mol H2 thu được là: n H 2 = 13 , 44 22 , 4 = 0 , 6 m o l
Sơ đồ phản ứng:
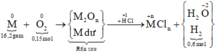
Các quá trình nhường, nhận electron cho cả quá trình:
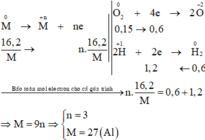

\(n_{H_2}=\dfrac{13.44}{22.4}=0.6\left(mol\right)\)
\(n_{M\left(pu\right)}=a\left(mol\right)\)
Bảo toàn e :
\(na=0.15\cdot4+0.6\cdot2=1.8\)
\(a=\dfrac{1.8}{n}\)
\(M=\dfrac{16.2}{\dfrac{1.8}{n}}=9n\)
\(n=3\Rightarrow M=27.M:Al\)

Do khi pư HCl có khí thoát ra nên X dư sau pư với O2
2X + nO2 --> X2On
\(\frac{0.6}{n}\) 0.15 mol
2X + 2nHCl --> 2XCln +nH2
\(\frac{0.1}{n}\) 0.05 mol
Ta có
nX(dư) =\(\frac{6.3}{X}-\frac{0.6}{n}\) =\(\frac{0.1}{n}\) mol
=> X = 9n => n =9 thì X là Al

Ta có: \(n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
Coi hh chất rắn gồm M và O.
⇒ nO = 0,15.2 = 0,3 (mol)
Ta có: \(n_M=\dfrac{16,2}{M_M}\left(mol\right)\)
BT e, có: n.nM = 2nO + 2nSO2 + 6nS
\(\Rightarrow\dfrac{16,2n}{M_M}=1,8\Rightarrow M_M=9n\left(g/mol\right)\)
Với n = 3 thì MM = 27 (g/mol) là thỏa mãn.
Vậy: M là Al.
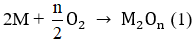
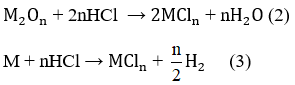
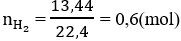
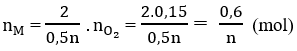
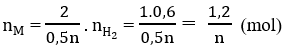
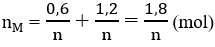
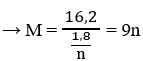

Gọi hoá trị của X là n(n thuộc tập số nguyên dương)
Gọi chất rắn sau khi nung là Y.
Có: X dư, X2On.
\(n_{H_2}=\frac{1,12}{22,4}=0,2\left(mol\right)\)
PTHH: 4X + nO2 ---> 2X2On
2X + 2nHCl --------> 2XCln + nH2
Số mol X: \(\frac{0,6}{n}\left(mol\right)\)
Số mol O2: 0,15(mol)
Số molX(pt 2):\(\frac{0,1}{n}\left(mol\right)\)
Số mol XCln: 0,05(mol)
Ta có: nX= \(\frac{0,6}{n}+\frac{0,1}{n}=\frac{0,7}{n}\)
=> MX = \(\frac{6,3n}{0,7}\)đvC
Lập bảng biện luận
Cho n từ 1 ta thấy n=3 TM
=> M(X)=27
Vậy kim loại X là Al và CTHH của oxit là Al2O3.
#Walker
Thịnh Phạm
Gọi hoá trị của X là n.
Gọi chất rắn sau khi nung là Y. Trong Y có: X dư, X2On.
nH2 = 1.12/22.4=0.05 mol
PTHH: 4X + nO2 ---> 2X2On
\(\dfrac{0.6}{n}\) ......0.15
2X + 2nHCl --------> 2XCln + nH2
\(\dfrac{0.1}{n}\)...........................................0.05
Ta có: nX= \(\dfrac{0.6}{n}\) + \(\dfrac{0.1}{n}\) = \(\dfrac{0.7}{n}\) mol
=> MX = \(\dfrac{6.3}{\dfrac{0.7}{n}}\) đvC
Lập bảng biện luận
Vậy kim loại X là Al và CTHH của oxit là Al2O3.