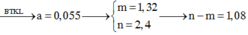cho m1 gam Al vào 100ml dung dịch gồm Cu(NO3)2 0,3M và AgNO3. sau khi các pư xảy ra hoàn toàn thu đk m2 gam chất rắn X. nếu cho m2 gam X td vs lượng dư dung dịch HCl thì thu đk 0,336l khí đktc. m1 và m2 lần lượt là?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn C
m2 gam X có thể phản ứng với HC1 tạo H2 Þ Có Al dư Þ nAl dư = 0,03/1,5 = 0,02
Vì AI dư Þ Toàn bộ Ag+ và Cu2+ đã bị khử hết về kim loại đơn chất
BTE Þ 3nAl phản ứng = 0,03x2 + 0,03 = 0,09 Þ nAl phản ứng = 0,03
Vậy m1 = (0,03 + 0,02)x27 = 1,35; m2 = 0,02x27 + 0,03x64 + 0,03x108 = 5,7

Đáp án A
Vì Al(OH)3 là 1 hyđroxit lưỡng tính
⇒ có thể tác dụng với axit và bazo.
Cho X vào HCl mà tạo khí thì trong X chắc chắn có Al (do Cu và Ag không phản ứng với HCl).
Do có Al nên Cu2+ và Ag+ phản ứng hết.
Số mol Al ban đầu:
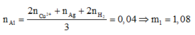
![]()

Đáp án A
Do X tác dụng được với HCl ⇒ Al dư. Bảo toàn electron: nAl dư = 0,01 mol.
Bảo toàn gốc NO3: nNO3–/dung dịch sau = 0,09 mol. Bảo toàn điện tích: nAl3+ = 0,03 mol.
► Bảo toàn nguyên tố Al: m1 = 27 × (0,03 + 0,01) = 1,08(g). Lại có :
X gồm 0,03 mol Cu; 0,03 mol Ag và 0,01 mol Al dư ||⇒ m2 = 5,43(g)
⇒ chọn A

Chọn đáp án A
Chất rắn X có thể có Al, Cu và chắc chắn có Ag.
Cho X vào HCl mà tạo khí thì trong X chắc chắn có Al (do Cu và Ag không phản ứng với HCl).
Do có Al nên Cu2+ và Ag+ phản ứng hết.
Số mol Al ban đầu:
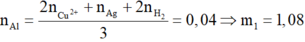
![]()
⇒ Chọn A

Thứ tự p/ư xảy ra
Al+ 3AgNO3------>Al(NO3)3+ 3Ag↓ (1)
0.01....0.03...................0.01........0.03
2Al+ 3Cu(NO3)2------>2Al(NO3)3+ 3Cu↓ (2)
0.02......0.03.....................0.02............0.03
Vì có khí H2 thoát ra chứng tỏ Al dư
2Al+ 6HCl-------> 2AlCl3+ 3H2(3)
0.01.....0.03..............0.01......0.015
nH2=0.015 mol
nAgNO3=nCu(NO3)2=0.03 mol
Ta có: ΣnAl=0.01+0.02+0.01=0.04 mol
=> m1=0.04*27=1.08 g
Rắn X gồm Cu, Ag và Al dư
=>m2=0.03*64+0.03*108+0.01*27=5.43 g

Đáp án C
Dung dịch Y chứa Mg2+ (x mol), Fe2+ (y mol), Cl- (0,06 mol) và NO3- (0,13 mol)
Ta có: