Khi đun 4,82 g muối Cu(NO3)2.nH2O đến khi mất hết nước thì khối lượng của muối đem đun giảm 1,08g . Xác định công thức của muối
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Gọi công thức phân tử của este X là CxHyOz.
.
a ax a. (mol)
Ta có : (mol) ;
(mol)
=> mO = 7,4 – 0,3.12 -0,3.2 = 3,2g ; nO = 0,2 (mol)
=> x : y : z = 3 : 6 : 2
Vì X là este đơn chức nên công thức phân tử của X là C3H6O2
b)
nX = 0,1 mol, nY = 0,1 mol.
MY = 32g/mol => CTPT của Y : CH3OH
CTPT của X : CH3COOCH3.
CH3COOCH3 + NaOH -> CH3COONa + CH3OH.
MZ = 0,1.82 = 8,2g
a) Gọi công thức phân tử của este X là CxHyOz.
.
a ax a. (mol)
Ta có : (mol) ;
(mol)
=> mO = 7,4 – 0,3.12 -0,3.2 = 3,2g ; nO = 0,2 (mol)
=> x : y : z = 3 : 6 : 2
Vì X là este đơn chức nên công thức phân tử của X là C3H6O2
b)
nX = 0,1 mol, nY = 0,1 mol.
MY = 32g/mol => CTPT của Y : CH3OH
CTPT của X : CH3COOCH3.
CH3COOCH3 + NaOH -> CH3COONa + CH3OH.
MZ = 0,1.82 = 8,2g

a) \(\%Mg=\dfrac{24}{24+2.M_X+18n}.100\%=11,82\%\)
=> MX + 9n = 89,523
Xét n = 5 => MX = 44,5 (Loại)
Xét n = 6 => MX = 35,5 => X là Cl
Xét n = 7 => MX = 26,5 (Loại)
Xét n = 8 => MX = 17,5 (loại)
Vậy CTHH của tinh thể là MgCl2.6H2O
b) \(\%Cl=\dfrac{35,5.2}{203}.100\%=34,975\%\)
c) \(n_{MgCl_2.6H_2O}=\dfrac{40,6}{203}=0,02\left(mol\right)\)
=> nH = 0,02.12 = 0,24 (mol)
=> \(n_{H_3PO_4}=\dfrac{0,24}{3}=0,08\left(mol\right)\)
=> mH3PO4 = 0,08.98 = 7,84 (g)

Gọi Công thức của muối là XNO3
XNO3 (nhiệt độ)----> XNO2+ 1/2 O2
Khối lượng muối giảm là khối lượng của O2
suy ra m(O2)=15,84%. 10,1=1,6 suy ra n(O2)=0.05
suy ra n(muối)=0.1 suy ra M(muối)= 10,1/0.1=101
suy ra X=101-62=39 suy ra X là Kali
V(O2)=0.05.22,4=1,12 l

Ta có:mCuSO4=12,5-4,5=8(g)\(\Rightarrow\)nCuSO4=\(\frac{8}{160}\)=0,05(mol)
Mà nCuSO4=nCuSO4.xH2O=0,05(mol)
\(\Rightarrow\)0,05.(160+18x)=12,5\(\Rightarrow\)160+18x=250\(\Rightarrow\)18x=90\(\Rightarrow\)x=5
Vậy CTHH của muối ngậm nước là:CuSO4.5H2O

a) Gọi công thức phân tử của este X là CxHyOz.
a ax a.
y\2 (mol)Ta có :
(mol) ;
(mol)
=> mO = 7,4 – 0,3.12 -0,3.2 = 3,2g ; nO = 0,2 (mol)
=> x : y : z = 3 : 6 : 2
Vì X là este đơn chức nên công thức phân tử của X là C3H6O2
b)
nX = 0,1 mol, nY = 0,1 mol.
MY = 32g/mol => CTPT của Y : CH3OH
CTPT của X : CH3COOCH3.

Đáp án C
Catot (−):
C u 2 + + 2 e → C u A g + + 1 e → A g n e = I t n F = 2 n C u + n A g = 0 , 06 m o l m c a t o t t ă n g = m C u + m A g = 4 , 2 g n C u = n C u 2 + = 0 , 015 m o l → C M ( C u 2 + ) = 0 , 075 M

Đặt CTPT của muối cacbonat ngậm nước là:

Vậy CTPT của muối cacbonat ngậm nước là Na 2 CO 3 . H 2 O
Đáp án: A
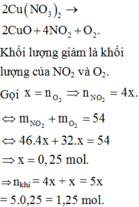
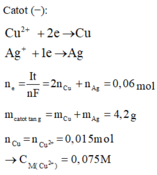
mCu(NO3)2=4,82-1,08=3,74(g)
nCu(NO3)2=0,02(mol)
nH2O=0,06(mol)
n=\(\dfrac{0,06}{0,02}=3\)
Vậy CTHH của muối là Cu(NO3)2.3H2O
Theo đề bài \(n_{H_2O\left(\text{muối}\right)}=1,08g\) ( vì khi đun nước bay hơi còn muối khan )
=> \(n_{H_2O}=\dfrac{1,08}{18}=0,06\) mol
\(m_{Cu\left(NO_3\right)_2}=3,74g\)
=> \(n_{Cu\left(NO_3\right)_2}=\dfrac{3,74}{188}=0,02\) mol
Có \(\dfrac{n_{Cu\left(NO_3\right)_2}}{n_{H_2O}}=\dfrac{1}{n}\) ( 1 là hệ số của \(Cu\left(NO_3\right)_2\) trong muối )
<=> \(\dfrac{0,02}{0,06}=\dfrac{1}{n}\)
<=> \(n=3\)
Vậy CTHH muối là \(Cu\left(NO_3\right)_2\)\(.3H_2O\)