Cho 150gam dung dịch K2CO3 tác dụng với 200 gam dung dịch H2SO4. Sau phản ứng thu được dung dịch muối có nồng độ 10,2 %. xác định C% dung dịch K2CO3 và dung dịch H2SO4 ban đầu.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
\(n_{H_2}=\dfrac{0,6}{2}=0,3\left(mol\right)\)
PTHH: 2M + 3H2SO4 --> M2(SO4)3 + 3H2
0,2<----0,3<--------0,1<-------0,3
=> \(M_M=\dfrac{5,4}{0,2}=27\left(g/mol\right)\)
=> M là Al
b) \(C\%_{dd.H_2SO_4}=\dfrac{0,3.98}{395,2}.100\%=7,44\%\)
c)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,2-->0,6
=> \(V_{dd.HCl}=\dfrac{0,6}{1}=0,6\left(l\right)=600\left(ml\right)\)

![]()
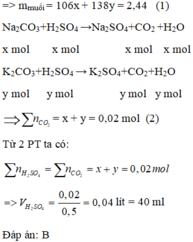
Đặt x, y lần lượt là số mol của Na 2 CO 3 và K 2 CO 3 (x, y > 0)

Chọn B
Đặt x,y lần lượt là số mol của N a 2 C O 3 và (x,y>0)
N a 2 C O 3 + H 2 S O 4 → N a 2 S O 4 + C O 2 + H2O (1)
x mol x mol x mol x mol
K 2 C O 3 + H 2 S O 4 → K 2 S O 4 + C O 2 + H 2 O (2)
y mol y mol y mol y mol
Từ phương trình ta dễ thấy muối cacbonat tác dụng với H 2 S O 4 thì
n H 2 S O 4 = n C O 2
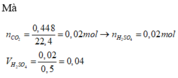

a) Vì: mA < 400 (g) nên phải có khí thoát ra → muối có dạng MHSO4 và khí là: CO2
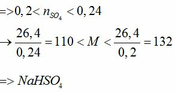
b)
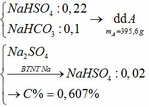
c) Tác dụng được với: MgCO3, Ba(HSO3)2, Al2O3, Fe(OH)2, Fe, Fe(NO3)2
Pt: 2NaHSO4 + MgCO3 → Na2SO4 + MgSO4 + CO2↑ + H2O
2NaHSO4 + Ba(HSO3)2 → BaSO4 + Na2SO4 + SO2↑ + 2H2O
6NaHSO4 + Al2O3 → 3Na2SO4 + Al2(SO4)3 + 3H2O
2NaHSO4 + Fe(OH)2 → Na2SO4 + FeSO4 + 2H2O
2NaHSO4 + Fe → Na2SO4 + FeSO4 + H2↑
12NaHSO4 + 9Fe(NO3)2 → 5Fe(NO3)3 + 2Fe2(SO4)3 + 6Na2SO4 + 3NO↑ + 6H2O

\(n_{Al\left(OH\right)_3}=\dfrac{7,8}{78}=0,1mol\\ 2Al\left(OH\right)_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+6H_2O\\ 0,1................0,15.............0,05............0,3\\ C_{\%H_2SO_4}=\dfrac{0,15.98}{300}\cdot100\%=4,9\%\\ C_{\%Al_2\left(SO_4\right)_3}=\dfrac{0,05.342}{7,8+300}\cdot100\%=5,56\%\)

a) \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: Mg + H2SO4 --> MgSO4 + H2
0,1<----------------0,1<----0,1
=> mMg = 0,1.24 = 2,4 (g)
=> m = mCu = 10,2 - 2,4 = 7,8 (g)
b)
\(C_{M\left(MgSO_4\right)}=\dfrac{0,1}{0,5}=0,2M\)

\(n_{Al_2O_3}=\dfrac{10,2}{102}=0,1\left(mol\right)\)
PTHH: Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2
Mol: 0,1 0,1
\(m_{Al_2\left(SO_4\right)_3}=0,1.342=34,2\left(g\right)\)

n H2SO4=\(\dfrac{10\%.490}{2+32+16.4}=0,5mol\)
n Al2O3 =\(\dfrac{10,2}{27.2+16.3}=0,1mol\)
\(Al_2O_3+3H_2SO_4->Al_2\left(SO_4\right)_3+3H_2O\)
bđ 0,1............0,5
pư 0,1............0,3..................0,1
spu 0 ................0,2................0,1
=> sau pư gồm H2SO4 dư , Al2(S04)3 và H2O
m H2SO4 dư = \(0,2.\left(2+32+16.3\right)=19,6g\)
m Al2(SO4)3 = \(0,1\left(27.2+32.3+16.4.3\right)=34,2g\)
m dd = \(490+10,2=500,2g\)
% Al2(SO4)3 = \(\dfrac{34,2}{500,2}.100\sim6,84\%\)
% H2SO4 dư = \(\dfrac{19,6}{500,2}.100\sim3,92\%\)
K2CO3 + H2SO4 --> K2SO4 + CO2 + H2O
x(mol) x(mol) 44x(g)
Gọi x(mol) là số mol K2CO3
Khối lượng dung dịch sau phản ứng: 150 + 200 -44x = 350 - 44x
Ta có: 174x/(350 - 44x)= 10,2: 100= 0,102
Giải ta được: x = 0,2
Còn lại tao nghĩ mày tự giải được
biết rồi :v