Dùng 3,2 kg khí oxi để đốt cháy axetilen. Hỏi với lượng khí oxi như trên, có thể đốt cháy bao nhiêu m3 khí axetilen (đktc) ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) \(V_{C_2H_2}=\left(100-2\right)\%.20=19,6\left(dm^3\right)=19,6\left(l\right)\)
\(n_{C_2H_2}=\dfrac{19,6}{22,4}=0,875\left(mol\right)\)
PTHH: \(2C_2H_2+5O_2\xrightarrow[]{t^o}4CO_2+2H_2O\)
0,875-->2,1875->1,75--->0,875
b) \(V_{O_2}=2,1875.22,4=49\left(l\right)\)
c) \(\left\{{}\begin{matrix}m_{CO_2}1,75.44=77\left(g\right)\\m_{H_2O}=0,875.18=15,75\left(g\right)\end{matrix}\right.\)

a) \(n_{C_2H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: 2C2H2 + 5O2 --to--> 4CO2 + 2H2O
0,2--->0,5
=> VO2 = 0,5.22,4 = 11,2 (l)
b) Vkk = 11,2 : 20% = 56 (l)
Số mol C2H4 = 4,48 : 22,4 = 0,2 mol
Phương trình phản ứng đốt cháy etilen:
C2H4 + 3O2 t0→→t0 2CO2 + 2H2O
Pư: 0,2 0,6 0,4 (mol)
a) VO2VO2 =0,6 x 22,4 = 13,44 lít
b) VO2Vkk=20100=15VO2Vkk=20100=15 => Vkk = 5VO2VO2 = 5 x 13,44 = 67,2 lít

a, Ta có: \(n_{C_2H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PT: \(2C_2H_2+5O_2\underrightarrow{^{t^o}}4CO_2+2H_2O\)
\(n_{O_2}=\dfrac{5}{2}n_{C_2H_2}=0,5\left(mol\right)\Rightarrow V_{O_2}=0,5.22,4=11,2\left(l\right)\)
b, \(V_{kk}=\dfrac{V_{O_2}}{20\%}=56\left(l\right)\)
c, - Hiện tượng: Br2 nhạt màu dần.
PT: \(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)

PTHH: 2C2H2 + 5O2 --to--> 4CO2 + 2H2O
\(\dfrac{V_{O_2}}{V_{C_2H_2}}=\dfrac{n_{O_2}}{n_{C_2H_2}}=\dfrac{5}{2}\Rightarrow V_{O_2}=2,5.\dfrac{5}{2}=6,25\left(l\right)\)
=> \(V_{kk}=6,25.5=31,25\left(l\right)\)

Câu 1:
a) \(n_{C_2H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: \(2C_2H_2+5O_2\xrightarrow[]{t^o}4CO_2+2H_2O\)
0,05--->0,125
\(\Rightarrow V_{O_2}=0,125.22,4=2,8\left(l\right)\)
b) \(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
0,05-->0,1
\(\Rightarrow V=V_{ddBr_2}=\dfrac{0,1}{1}=0,1\left(l\right)\)
Câu 2:
a) \(n_{C_2H_2}=\dfrac{16,8}{26}=\dfrac{42}{65}\left(mol\right)\)
PTHH: \(2C_2H_2+5O_2\xrightarrow[]{t^o}4CO_2+2H_2O\)
\(\dfrac{42}{65}\)----->\(\dfrac{21}{13}\)----->\(\dfrac{84}{65}\)
\(\Rightarrow V_{kk}=5.\dfrac{21}{13}.22,4=\dfrac{2352}{13}\left(l\right)\)
b) \(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
\(\dfrac{84}{65}\)----->\(\dfrac{84}{65}\)
\(\Rightarrow m_{CaCO_3}=m_{kt}=\dfrac{84}{65}.100=\dfrac{1680}{13}\left(g\right)\)
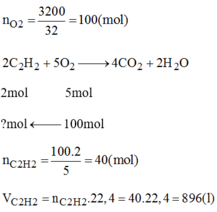
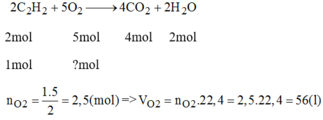
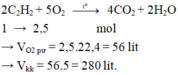

2C2H2+5O2\(\overset{t^0}{\rightarrow}\)4CO2+2H2O
\(n_{O_2}=\dfrac{3,2.1000}{32}=100mol\)
\(n_{C_2H_2}=\dfrac{2}{5}n_{O_2}=\dfrac{2}{5}.100=40mol\)
\(V_{C_2H_2}=n.22,4=40.22,4=896l=0,896m^3\)