Cho 4,15 gam Fe, Al ở dạng bột tác dụng với 200ml dd CuSO4 0,525M. Khuấy kĩ hỗn hợp để phản ứng xảy ra hhoàn toàn thu được kết tủa A. Đem lọc rửa kết tủa A thu được hai kim loại có khối lượng 7,84gam và dd nước lọc B. Để hòa tan hoàn toàn kết tủa A cần ít nhất bao nhiêu ml dd HNO3 2M chỉ giải phóng khí NO
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


n C u S O 4 = 0,525.0,2 = 0,105 m o l
Vì thu được kết tủa là 2 kim loại nên Fe còn dư.
Suy ra, kết tủa là Fe dư và C u , C u S O 4 phản ứng hết.
Gọi a, b, c là số mol của Al phản ứng, Fe phản ứng và Fe dư.
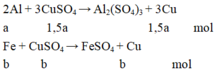
Từ phương trình phản ứng và dữ kiện đề bài cho, ta lập được hệ phương trình:
3 2 a + b = n C u S O 4 a .27 + b .56 + c .56 = m K L 3 2 a .64 + b .64 + c .56 = m k e t t u a ⇔ 3 2 a + b = 0,105 27 a + 56 b + 56 c = 4,15 96 a + 64 b + 56 c = 7,84
⇔ a = 0,05 b = 0,03 c = 0,02
Vậy n A l = 0 , 05 m o l ; n F e b đ = b + c = 0 , 05 m o l .
Đáp án C

Đáp án C
Phản ứng xảy ra với Al trước, sau đó đến Fe. Theo giả thiết, kim loại sinh ra là Cu (kim loại hóa trị II).
Gọi x là số mol Al, y là số mol Fe phản ứng và z là số mol Fe dư:
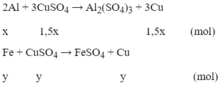
Ta có:
27x + 56(y + z) = 4,15 (1)
3x/2 + y = 0,280.525 = 0,105 (mol) (2)
64(1,5x + y) + 56y = 7,84 (3)
Phản ứng:
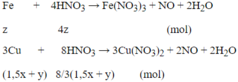
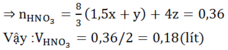

Đáp án C.
Chất rắn sau phản ứng gồm 2 kim loại → 2 kim loại đó là Cu và Fe , Al đã phản ứng hết → CuSO4 không dư → nCu = 0,105 mol => m= 6,72 gam → còn 1,12 gam là của Fe .
Phản ứng : Fe + 4HNO3 → Fe(NO3)3 + NO +2H2O
nFe = 0,02 mol → nHNO3= 0,08 mol .
n F e 3 + = 0,02 mol
chú ý phản ứng: Cu + 2Fe3+ → Cu2+ + 2Fe2+
⇒ 0,01 mol Cu + 0,02 mol Fe3+ → 0,01 mol Cu2+ và 0,02 mol Fe2+ )
Để HNO3 cần dùng là tối thiểu thì cần dùng 1 lượng hòa tan vừa đủ 0,105 – 0,01 = 0,095 mol Cu
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Từ đây tính được nHNO3= 0,095. 8 3 = 0,253 mol
→ tổng nHNO3 đã dùng là 0,253 + 0,08 = 0,333 mol
→ = 0,16667 lít = 166,67 ml

Theo đề bài ta có : nCuSO4 = 0,2.0,525 = 0,105 (mol)
Ta có PTHH:
\(Fe+C\text{uS}O4->FeSO4+Cu\)
\(2Al+3CuSO4->Al2\left(SO4\right)3+3Cu\)
Theo 2 PTHH ta có : nCu = nCuSO4 = 0,105 (mol)
Ta có : mA = mFe(dư) + mCu(thu được) => mFe(dư) = 7,84-0,105.64 = 1,12(g) => nFe(dư) = \(\dfrac{1,12}{56}=0,02\left(mol\right)\)
PTHH :
\(Fe+4HNO3->Fe\left(NO3\right)3+NO\uparrow+2H2O\)
0,02mol...0,08mol
\(3Cu+8HNO3->3Cu\left(NO3\right)2+2NO\uparrow+4H2O\)
0,105mol..0,28mol
=> CMddHNO3 = \(\dfrac{\left(0,08+0,28\right)}{2}=0,18\left(l\right)\)
Vậy...

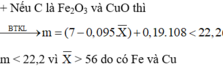


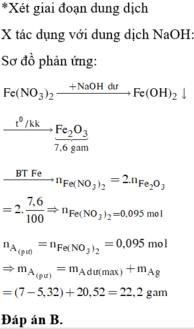


Kết tủa A gồm 2 kim loại là Cu và Fe dư → CuSO4 và Al phản ứng hết.
n(CuSO4) = 0,525.0,2 = 0,105mol
Theo ĐL bảo toàn nguyên tố: n(Cu) = n(CuSO4) = 0,105mol
Khối lượng Fe dư:
m(Fe dư) = m(A) - m(Cu) = 7,84 - 0,105.64 = 1,12g
Gọi x, y là số mol Al và Fe tham gia pư:
m(hh KL) = m(Al) + m(Fe pư) + m(Fe dư) = 27x + 56y + 1,12 = 4,15g
Cho hh kim loại vài dung dịch CuSO4
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
x 3x/2
Fe + CuSO4 → FeSO4 + Cu
y y
n(CuSO4) = 3x/2 + y = 0,105mol
→ x = 0,05mol và y = 0,03mol
Khối lượng mỗi kim loại:
m(Al) = 0,05.27 = 1,35g
m(Fe) = m(Fe pư) + m(Fe dư) = 56.0,03 + 1,12 = 2,8g
A chứa 2 kim loại là Cu và Fe dư →Al phản ứng hết,Fe phản ứng một phần ,Cu2 bị khử hết
Đặt a,b,c là số mol Al , Fe phản ứng và Fe dư
→ 27a + 56(b+c) = 4,15
bảo toàn electron → 3a + 2b = 0,105.2
mA= 56c + 0,105.64 = 7,84
Giả hệ → a=0,05 ; b=0,03 ; c=0,02
A gồm Cu (0,105)và Fe dư(0,02)
bảo toàn electron: 2ncu + 3nFe dư = 3nNO
→ nNO = 0,09
→ nHNO3 = 4nNO = 0,36 mol
→ V=180ml