Hỗn hợp X gồm Na và Al. Cho m gam X vào 1 lượng nước dư thì thoát ra V lít khí. Nếu cũng cho m gam X vào dd NaOH dư thì được 1,75V lít khí. Hãy tính thành phần % theo khối lượng của Na trong hỗn hợp
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Ta thấy 1,75 lít > 1 lít
Chứng tỏ phần tác dụng với nước thì n Na = n NaOH không tác dụng hết n Al, còn phần sau là mới tác dụng hết
Na + H2O --> NaOH + 1/2.H2
x ---- ------ --------> x -----> x/2
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
x <-----x ------------ ------- ------- ------- -> 3x/2
=> x/2 + 3x/2 = 1 <=> x = 0.5
Ta tính số mol do Al sinh ra là = 1.75 - 0.5/2 = 1,5 mol
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
1 <---------- --------- ---------- ----------- 1,5 mol
% m Al = ( 1.27 ) / (1.27 + 0.5.23 ) x 100% = 70,13%
=> %Na = 29,87%
=> Đáp án B

Đáp án C
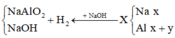
Gọi số mol của Na và Al trong hỗn hợp X lần lượt là x và y mol
Vì tỉ lệ thể tích cũng là tỉ lệ số mol => coi như thí nghiệm 1 thu được a mol khí và thí nghiệm 2 thu được 1,75a mol
Cho hỗn hợp X vào nước, Na phản ứng hết tạo NaOH và Al phản ứng với NaOH và còn dư => tính số mol theo NaOH
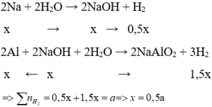
Cho hỗn hợp X tác dụng với dung dịch NaOH dư => Na phản ứng hết với H2O và Al phản ứng hết với NaOH
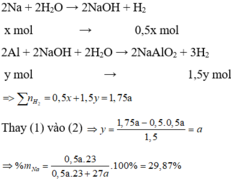

Ta thấy ở trường hợp 2 cho m gam X vào dung dịch NaOH dư thì được 1,75V lít khí
Còn ở trường hợp 1 cho hỗn hợp X vào nước, Na phản ứng hết tạo NaOH và Al phản ứng với NaOH thì thoát ra V lít khí
=> Số mol H2 ở TH2 1,75V lít > Số mol H2 ở TH 1 V lít
Chứng tỏ phần tác dụng với nước thì nNa = nNaOH không tác dụng hết nAl, còn phần sau là mới tác dụng hết.

Ta thấy 1,75 lít > 1 lít
Chứng tỏ phần tác dụng với nước thì n Na = n NaOH không tác dụng hết n Al, còn phần sau là mới tác dụng hết
Na + H2O --> NaOH + 1/2.H2
x ---- ------ --------> x -----> x/2
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
x <-----x ------------ ------- ------- ------- -> 3x/2
=> x/2 + 3x/2 = 1 <=> x = 0.5
Ta tính số mol do Al sinh ra là = 1.75 - 0.5/2 = 1,5 mol
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
1 <---------- --------- ---------- ----------- 1,5 mol
% m Al = ( 1.27 ) / (1.27 + 0.5.23 ) x 100% = 70,13%
=> %Na = 29,87%

Coi V = 22,4(lít)
Thí nghiệm 1 : $Al$ dư
$n_{H_2} = 1(mol)$
Gọi $n_{Na} = a(mol)$
$2Na + 2H_2O \to 2NaOH + H_2$
$2Al + 2NaOH + 2H_2O \to 2NaAlO_2 + 3H_2$
Theo PTHH :
$n_{H_2} = 0,5a + 1,5a = 1 \Rightarrow a = 0,5(mol)$
Thí nghiệm 2 : $Al$ hết
Gọi $n_{Al} = b(mol)$
Theo PTHH :
$n_{H_2} = \dfrac{1}{2}n_{Na} + \dfrac{3}{2}n_{Al}$
$\Rightarrow \dfrac{1}{2}.0,5 + \dfrac{3}{2}b = 1,75$
$\Rightarrow b = 1(mol)$
Ta có :
$\%m_{Na} = \dfrac{0,5.23}{0,5.23 + 1.27}.100\% = 29,87\%$
Đáp án D

Cho V lít = 1 lít ; số lít coi như là số mol cho dễ tính
Ta thấy 1,75 lít > 1 lít
Chứng tỏ phần tác dụng với nước thì n Na = n NaOH không tác dụng hết n Al
Còn phần sau là mới tác dụng hết
Na + H2O --> NaOH + 1/2.H2
x ---- ------ --------> x -----> x/2
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
x <-----x ------------ ------- ------- ------- -> 3x/2
=> x/2 + 3x/2 = 1 <=> x = 0.5
Ta tính số mol do Al sinh ra là = 1.75 - 0.5/2 = 1,5 mol
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
1 <---------- --------- ---------- ----------- 1,5 mol
% m Al = ( 1.27 ) / (1.27 + 0.5.23 ) x 100% = 70,13%

Đáp án D
Do các khí đo ở cùng điều kiện nên ta “có thể” coi V như số mol để tính cho đơn giản.
TH1:
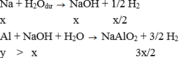
TH2:
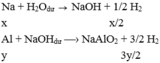
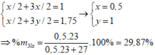


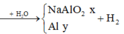

-Gọi số mol Na là x, số mol Al là y
-X tác dụng với H2O:
2Na+2H2O\(\rightarrow\)2NaOH+H2
x\(\rightarrow\).................x............\(\dfrac{x}{2}\)
2Al+2NaOH+2H2O\(\rightarrow\)2NaAlO2+3H2
x.....\(\leftarrow\)x\(\rightarrow\).....................................\(\dfrac{3x}{2}\)
V=(\(\dfrac{x}{2}+\dfrac{3x}{2}\)).22,4=2x.22,4 lít(I)
-X tác dụng với NaOH:
2Na+2H2O\(\rightarrow\)2NaOH+H2
x\(\rightarrow\).................x............\(\dfrac{x}{2}\)
2Al+2NaOH+2H2O\(\rightarrow\)2NaAlO2+3H2
y\(\rightarrow\)..............................................\(\dfrac{3y}{2}\)
1,75V=\(\left(\dfrac{x}{2}+\dfrac{3y}{2}\right).22,4=\left(\dfrac{x+3y}{2}\right).22,4\)lít(II)
-Lập tỉ số: \(\dfrac{\left(II\right)}{\left(I\right)}\)ta có:
\(1,75=\dfrac{\dfrac{x+3y}{2}}{2x}=\dfrac{x+3y}{4x}\)
\(\rightarrow\)1,75.4x=x+3y\(\rightarrow\)7x=x+3y\(\rightarrow\)6x=3y\(\rightarrow\)2x=y
%Na=\(\dfrac{23x}{23x+27y}.100=\dfrac{23x.100}{23x+27.2x}=\dfrac{2300}{23+27.2}\approx29,87\%\)