Trộn V1 lít dd HCl 0,6M với V2 lít NaOH 0,4M thu được 0,6 lít dd A. Tính V1 , V2 biết 0,6 lít dd A có thể hòa tan hết 1,02 gam Al2O3. Coi sự pha trộn không làm thay đổi thể tích.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nHCl=0,6V1 mol; n NaOH=0,4V2 mol
Do dd A có thể hòa tan Al2O3=> HCl hoặc NaOH dư
*TH1: HCl dư
Al2O3+6HCl-> 2AlCl3+3H2O nAl2O3=0,01 mol=> nHCl dư =0,06 mol
nHCl phản ứng= n NaOH=0,4V2 mol=>n HCl dư = 0,6V1-0,4V2=0,06 mol
V1+V2=0,6l
giải hpt ra V1=V2=0,3l
*TH2: NaOH dư
2NaOH+Al2O3-> 2NaAlO2+H20 (3)
n NaOH dư=2nAl2O3=0,02 mol
=>nNaOH dư= 0,4V2-0,6V1=0,02 mol
V1+V2=0,6l
giải hpt ra V1=0,22l, V2=0,38l

Phùng Hà ChâuThảo Phương muốn đặt tên nhưng chưa nghĩ ra bạn nào tốt nghĩ giùm mkNguyễn Anh ThưKhánh Như Trương NgọcTrTrần Hữu Tuyểnần Ánh ThuKagamine Len love Vocaloid02Ten Hoànghuyền thoại đêm trăngNguyễn Thị Kiều DuyênHoàng Tuấn ĐăngNguyễn Trần Thành ĐạtAzueRainbow
nAl2O3 = 0.1
nHCl = 0.6V1
nNaOH = 0.4V2
TH1: HCl dư
NaOH + HCl = NaCL + H2O
0.4V2----0.4V2
Al2O3 + 6HCl = 2AlCl3 + 3H2O
0.1----------0.6
có 0.6 = 0.6V1 - 0.4V2
V1 + V2 = 0.6
=> loại
TH2 : NaOH dư
NaOH + HCl = NaCL + H2O
0.6V1----0.6V1
2NaOH + Al2O3 = 2NaALO2 + H2O
0.2------------0.1
0.2 = 0.4V2 - 0.6V1
V1 + V2 = 0.6
=> V1 = 0.04,V2 = 0.56

$n_{HCl} = 0,6V_1(mol) ; n_{NaOH} = 0,4V_2(mol)$
$V_1 + V_2 = 0,6(1)$
TH1 : HCl dư
$n_{HCl\ dư} =0,6V_1 - 0,4V_2 (mol)$
$Al_2O_3 + 6HCl \to 2AlCl_3 + 3H_2$
$n_{HCl\ dư} = 6n_{Al_2O_3} = 0,12(mol)$
$\Rightarrow 0,6V_1 - 0,4V_2 = 0,12(2)$
Từ (1)(2) suy ra $V_1 = 0,36(lít) ; V_2 = 0,34(lít)$
TH2 : NaOH dư
$n_{NaOH\ dư} = 0,4V_2 - 0,6V_1(mol)$
$2NaOH + Al_2O_3 \to 2NaAlO_2 + H_2O$
$n_{NaOH\ dư} = 0,4V_2 - 0,6V_1 = 2n_{Al_2O_3} = 0,04(3)$
Từ (1)(3) suy ra $V_1 = 0,2(lít) ; V_2 = 0,4(lít)$
AlO3 là chất gì em ha? Hay là Al2O3
Em xem lại đề em nha!

trộn V1 lít dung dịch HCl 0,6M với V2 lít dung dịch NaOH 0,4M thu được 0,6 lít dung dịch A.
=> V1 + V2 = 0,6 (1)
ta có số mol các chất là:
0,6V1 mol HCl
0,4V2 mol NaOH
0,01 mol Al2O3
để hòa tan được Al2O3 thì trong dd phải còn HCl dư hay là NaOH dư, ta xét 2 trường hợp:
trường hợp 1: HCl dư
NaOH + HCl ---> NaCl + H2O
0,4V2 --->0,4V2 mol
sau khi phản ứng với NaOH, HCl còn lại (0,6V1 - 0,4V2) mol
Al2O3 + 6HCl ---> 2AlCl3 + 3H2O
0,01 --- -->0,06 mol
vì HCl dư hòa tan được 0,01 mol Al2O3
=> số mol HCl dư là:
0,6V1 - 0,4V2 = 0,06 (2)
giải hệ PT gồm (1) và (2) ta được:
V1 = V2 = 0,3 lít
trường hợp 2: NaOH dư
---HCl + NaOH ---> NaCl + H2O
0,6V1-->0,6V1 mol
sau phản ứng trên, NaOH còn dư (0,4V2 - 0,6V1)
Al2O3 + 2NaOH ---> 2NaAlO2 + H2O
0,01 --- -->0,02 mol
=> số mol NaOH dư là:
0,4V2 - 0,6V1 = 0,02 (3)
giải hệ PT gồm (1) và (3) ta được:
V1 = 0,22 lít
V2 = 0,38 lít

\(a.BT\left[Cl\right]:n_{AgCl}=n_{HCl\left(X\right)}=\dfrac{35,875}{143,5}=0,25mol\\ HCl+NaOH->NaCl+H_2O\\ n_{HCl\left(Y\right)}=0,5.0,3=0,15mol\\ C_{M\left(Z\right)}=\dfrac{0,4}{2}=0,2\left(M\right)\\ b.Fe+2HCl->FeCl_2+H_2\\ n_{HCl\left(X\right)}=a;n_{HCl\left(Y\right)}=b\left(mol\right)\\ a-b=\dfrac{0,448}{22,4}.2=0,04mol\\ Từ\left(a\right)\Rightarrow n_{HCl\left(X\right)}:n_{HCl\left(Y\right)}=0,25:0,15=\dfrac{5}{3}=\dfrac{a}{b}\\ \Rightarrow a=0,1;b=0,06\\ C_{M\left(X\right)}=\dfrac{0,1}{0,1}=1M\\ C_{M\left(Y\right)}=\dfrac{0,06}{0,1}=0,6\left(M\right)\)
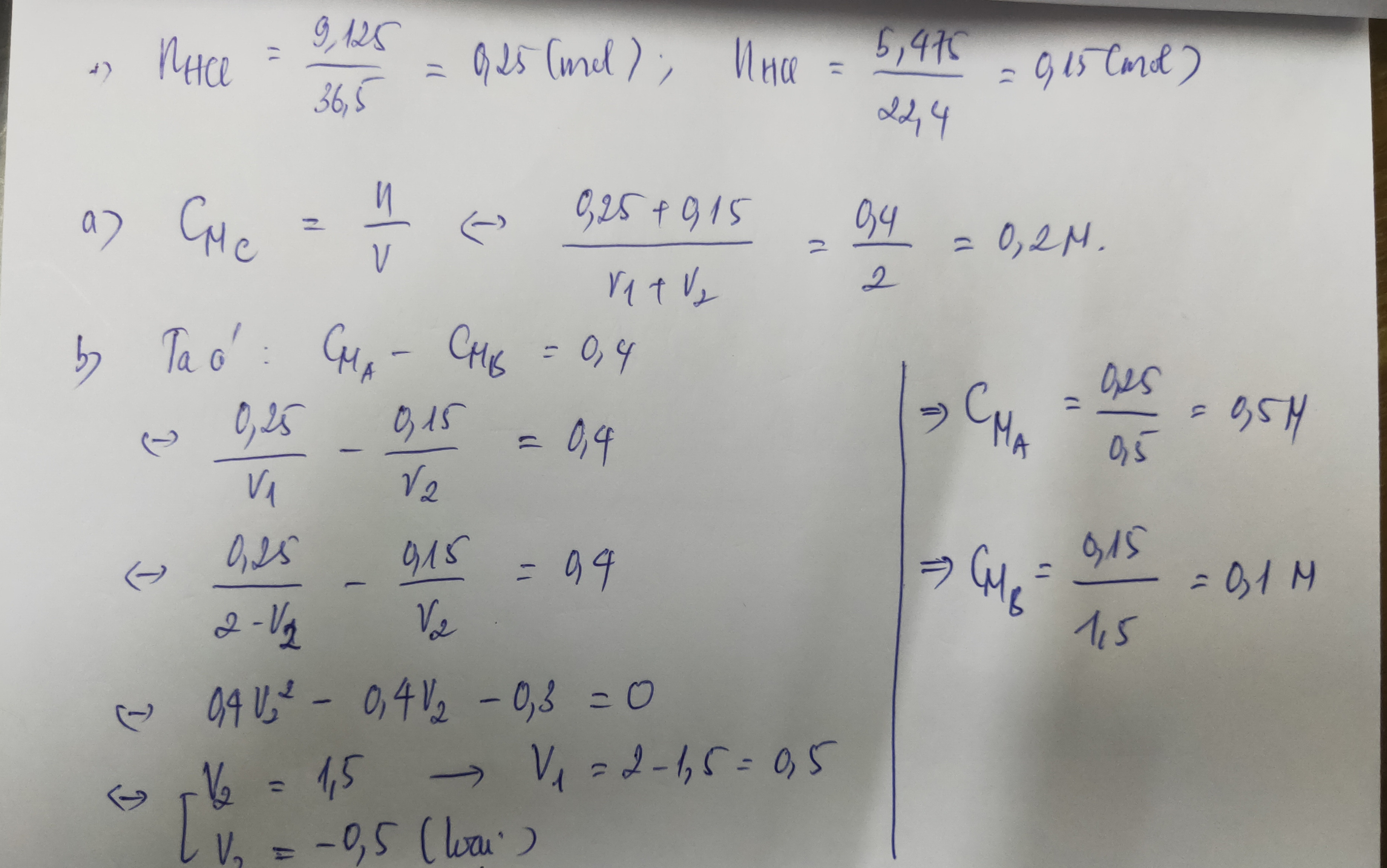
NaOH+HCl-> NaCl+H2O
nHCl=0,6V1 mol; n NaOH=0,4V2 mol
Do dd A có thể hòa tan Al2O3=> HCl hoặc NaOH dư
*TH1: HCl dư
Al2O3+6HCl-> 2AlCl3+3H2O nAl2O3=0,01 mol=> nHCl dư =0,06 mol
nHCl phản ứng= n NaOH=0,4V2 mol=>n HCl dư = 0,6V1-0,4V2=0,06 mol
V1+V2=0,6l
giải hpt ra V1=V2=0,3l
*TH2: NaOH dư
2NaOH+Al2O3-> 2NaAlO2+H20 (3)
n NaOH dư=2nAl2O3=0,02 mol
=>nNaOH dư= 0,4V2-0,6V1=0,02 mol
V1+V2=0,6l
giải hpt ra V1=0,22l, V2=0,38l