Bài 1: Để hòa tan 9,6g một hỗn hợp đồng mol(cùng số mol) của 2 oxit kim loại có hóa trị II cần 14,6g axit HCl. Xác định công thức của 2 oxit trên. Biết kim loại hóa trị II có thể là Be, Mg, Ca, Fe, Zn, Ba.
Bài 2: Khử 9,6g một hỗn hợp gồm Fe\(_2\)O\(_3\) và FeO bằng H\(_2\) ở nhiệt độ cao, người ta thu được Fe và 2,88g H\(_2\)O.
a/ Viết các PTHH xảy ra.
b/ Xác định thành phần % của 2 oxit trong hỗn hợp.
c/ Tính thể tích H\(_2\)(đktc) cần dùng để khử hế lượng oxit trên.
Cảm ơn nhé!

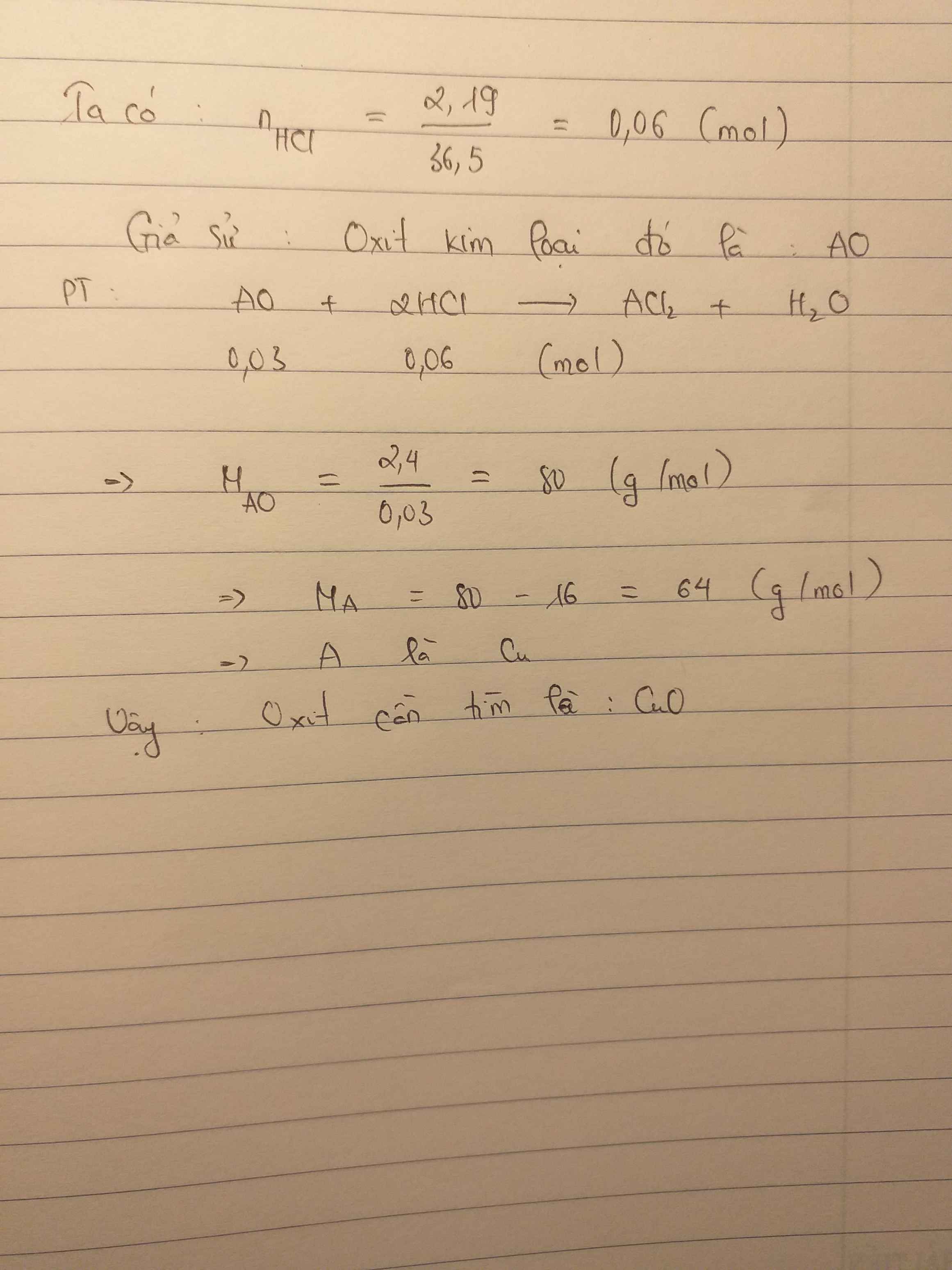
Bài 1:
Gọi CTTQ: AO, BO
........x là số mol của hai oxit
nHCl = \(\dfrac{14,6}{36,5}=0,4\) mol
Pt: AO + 2HCl --> ACl2 + H2O
.......x..........2x
.....BO + 2HCl --> BCl2 + H2O
......x..........2x
Ta có hệ pt: \(\left\{{}\begin{matrix}x\left(M_A+16\right)+x\left(M_B+16\right)=9,6\left(1\right)\\2x+2x=0,4\left(2\right)\end{matrix}\right.\)
Từ (2) giải ra x = 0,1
Thế x = 0,1 vào (1), ta được:
\(0,1\left(M_A+16\right)+0,1\left(M_B+16\right)=9,6\)
\(\Leftrightarrow0,1M_A+1,6+0,1M_B+1,6=9,6\)
\(\Leftrightarrow0,1M_A+0,1M_B=9,6-1,6-1,6=6,4\)
\(\Leftrightarrow M_A+M_B=6,4:0,1=64\left(3\right)\)
Thế các nguyên tố đầu bài vào (3), ta tìm được A là Mg, B là Ca (hoặc ngược lại)
Vậy CTTH của hai oxit: MgO, CaO
Bài 2:
Gọi x,y lần lượt là số mol của Fe2O3, FeO
nH2O = \(\dfrac{2,88}{18}=0,16\) mol
Pt: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
........x............3x.........................3x
.......FeO + H2 --to--> Fe + H2O
........y.........y.........................y
Ta có hệ pt: \(\left\{{}\begin{matrix}160x+72y=9,6\\3x+y=0,16\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,034\\y=0,06\end{matrix}\right.\)
P/s: bn bấm máy tính rồi tự làm tròn nha
=> %
nH2 = 3x + y = 3 . 0,034 + 0,06 = 0,162 mol
=> VH2 = 0,162 . 22,4 = 3,63 (lít)