Giải dùm em với

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Tự luận
Câu 1 :
Trích mẫu thử
Cho $Ba(HCO_3)_2$ vào mẫu thử
- mẫu thử tạo khí không màu là $HCl$
$Ba(HCO_3)_2 + 2HCl \to BaCl_2 + 2CO_2 + 2H_2O$
- MT tạo kết tủa trắng là $Na_2SO_4$
$Ba(HCO_3)_2 + Na_2SO_4 \to BaSO_4 + 2NaHCO_3$
- MT tạo khí không màu và kết tủa trắng là $H_2SO_4$
$Ba(HCO_3)_2 + H_2SO_4 \to BaSO_4 + 2CO_2 + 2H_2O$
- MT không hiện tượng là $NaCl$
Câu 2 :
$S + O_2 \xrightarrow{t^o} SO_2$
$2SO_2 + O_2 \xrightarrow{t^o} 2SO_3$
$SO_3 + H_2O \to H_2SO_4$
$NaCl + H_2SO_{4_{đặc}} \xrightarrow{t^o} NaHSO_4 + HCl$
Câu 3 :
a) $2Al + 6HCl \to 2AlCl_3 + 3H_2$
$n_{HCl} = 0,1.3 = 0,3(mol)$
$n_{Al} = \dfrac{1}{3}n_{HCl} = 0,1(mol)$
$n_{H_2} = \dfrac{1}{2}n_{HCl} = 0,15(mol)$
Suy ra:
$m = 0,1.27 = 2,7(gam)$
$V = 0,15.22,4 = 3,36(lít)$

Theo Định luật bảo toàn điện tích, ta có:
\(2.0,1+0,2.3=2y+0,2.1\\ \Leftrightarrow y=0,3\left(mol\right)\)
Khối lượng muối thu được là:
\(m_{muối}=m_{Fe^{2+}}+m_{Cl^-}+m_{Al^{3+}}+m_{SO_4^{2-}}\\ =56.0,1+35,5.0,2+0,2.27+96.0,3=46,9\left(g\right)\\ \Rightarrow B\)


2: Tọa độ là:
\(\left\{{}\begin{matrix}2x+1=x-3\\y=x-3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=-4\\y=-7\end{matrix}\right.\)



1.
(1) CuSO4 + Fe ➜FeSO4+Cu
(2) 2NaOH +FeSO4 ➜Na2SO4+Fe(OH)2
(3)Fe(OH)2 +2HCl ➞ FeCl2 +2H2O
(4)FeCl2➞ Fe +Cl2
(5) 2Fe + 6H2SO4➞Fe2(SO4)3 +3SO2 +6H2O
(6) 3Fe2(SO4)3 + BaCl2➞2FeCl3 +3BaSO4
2.
a) 2Al +3CuSO4➞Al2(SO4)3 +3Cu
- Hiện tượng xảy ra :Có chất rắn màu nâu đỏ chính là đồng bám bên ngoài lá nhôm ,màu xanh của dd CuSO4 nhạt dần
b)Zn + CuCl2 ➞ ZnCl2 +Cu
- Đồng clorua đang ở màu xanh lam ➝nhạt màu ➝xuất hiện chất rắn (kết tủa màu đỏ bám vào thanh kẽm)
c)2Na + 2H2O ➞ 2NaOH +H2
2NaOH +CuSO4 ➞Cu(OH)2+Na2SO4
- có khí không màu thoát ra ,thu đc kết tủa xanh đậm.

 giải dùm em voi
giải dùm em voi


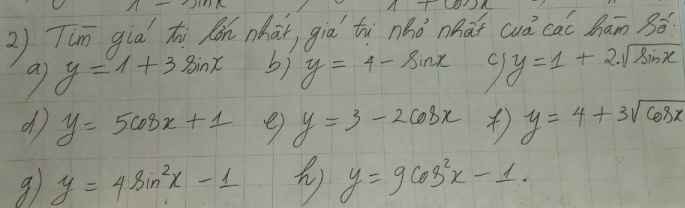

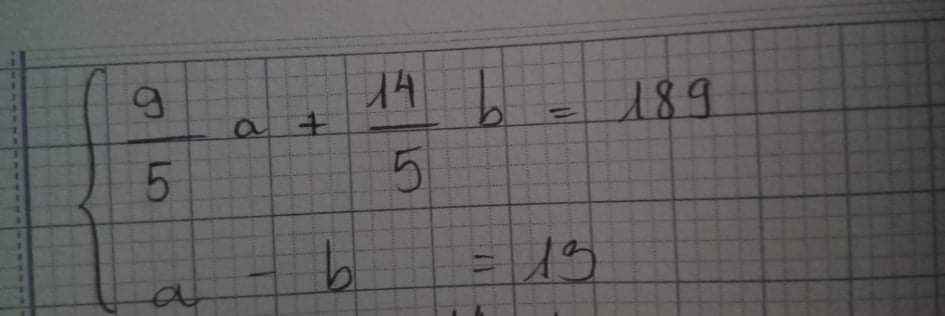

 giải dùm em với ạ
giải dùm em với ạ
Bài 4:
a: ĐKXĐ: \(x\ge\dfrac{3}{2}\)
b: ĐKXĐ: x>1
c: ĐKXĐ: x<-2
d: ĐKXĐ: \(x>2\)
e: ĐKXĐ: \(x< \dfrac{5}{2}\)
f: ĐKXĐ: \(x\ge2\)