Khi tổng hợp NH3 từ N2 và H2 (điều kiện thích hợp) thấy rằng nồng độ khi cân bằng của N2 là 0,02M ,H2:2M ,NH3:0.6M.Hằng số cân bằng của phản ứng là :
A.3,25 B.2,25 C.2 D.1,25
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(N_2+3H_2\underrightarrow{t^o}2NH_3\)
Ta có: \(K_C=\dfrac{\left[NH_3\right]^2}{\left[N_2\right]\left[H_2\right]^3}=\dfrac{0,6^2}{0,02.2^3}=2,25\)
Theo PT: \(\left[N_2\right]_{\left(pư\right)}=\dfrac{1}{2}\left[NH_3\right]=0,3\left(mol\right)\)
\(\Rightarrow H=\dfrac{0,3}{0,3+0,02}.100\%=93,75\%\)

`1>{1,2}/3->H` tính theo `H_2.`
Tại TTCB: `[H_2]=3/{2}[NH_3]=0,3M`
`->C_{H_2\ pu}=1,2-0,3=0,9M`
`->H={0,9}/{1,2}.100\%=75\%`
Không có đáp án đúng.

Đáp án A
Gọi số mol N2 phản ứng là x (mol).
Phản ứng: N2 (k) + 3H2 (k) D 2NH3 (k)
Ban đầu: 0,4M 0,6M 0
Phán úng: x 3x 2x
Cần bằng: (0,4-x) (0,6-3x) 2x
H2 chiếm 25% hỗn hợp sau phản ứng nên:
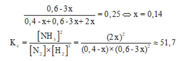

Đáp án A
Gọi số mol N2 phản ứng là x (mol).
Phản ứng: N2 (k) + 3H2 (k) D 2NH3 (k)
Ban đầu: 0,4M 0,6M 0
Phán úng: x 3x 2x
Cần bằng: (0,4-x) (0,6-3x) 2x
H2 chiếm 25% hỗn hợp sau phản ứng nên:
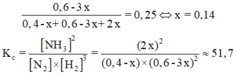

a)Tại tđ cân bằng:
\(\left[N_2\right]=0,5-\dfrac{1}{2}.0,1=0,5-0,05=0,45\left(M\right)\)
\(\left[H_2\right]=0,6-\dfrac{3}{2}.0,1=0,6-0,15=0,45\left(M\right)\)
\(\Rightarrow k_c=\dfrac{\left[NH_3\right]^2}{\left[N_2\right].\left[H_2\right]^3}=\dfrac{0,1^2}{0,45.0,45^3}\approx0,244\)
b) Để tăng H tổng hợp \(NH_3\), chúng ta có thể:
- Tăng P bằng cách giảm V (chọn P phù hợp)
- Giảm nhiệt độ của hệ ( chọn nhiệt độ phù hợp)
- Thêm \(N_2;H_2\)
N2+3H2\(\rightarrow\)2NH3
Kcb=\(\dfrac{\left[NH_3\right]^2}{\left[N_2\right].\left[H_2\right]^3}=\dfrac{0,6^2}{0,02.2^3}=2,25\)
Đáp án B