Ngâm 45,5g hỗn hợp bột các kim loại : Zn,Cu,Ag trong dung dịch HCl dư thu được 4,48l khí (đktc). Nếu nung 1 lượng hỗn hợp như trên trong không khí , phản ứng xog thu được hỗn hợp rắn mới có khối lượng là 51,9 g.
a,Viết PTPƯ
b, Tính thành phần % theo khối lượng có trong hỗn hợp ban đầu

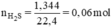
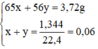
Khi cho tác dụng với HCl thì chỉ có Zn phản ứng
Zn + 2HCl ----> ZnCl2 + H2 (1)
0.2mol <------------------------- 0.2mol
Vậy khối lượng Zn = 13g
Nung hh trên trong không khí sẽ có các phản ứng:
Zn + O2 ----> ZnO (2)
0.2mol -----------------> 0.2mol = 16.2g
Cu + 1/2O2 ----> CuO
Ta nhận thấy Ag không phản ứng với Ôxi vậy khối lượng chất rắn tăng lên là do sự hình thành 2 ôxit ZnO và CuO. Số mol của O trong hổn hợp 2 ôxit = (51.9 - 45.5) / 16 = 0.4 mol
Theo PT (2) ta thấy số mol của O trong ZnO =số mol của ZnO = 0.2 mol, vậy số mol của O trong CuO = 0.4 - 0.2 = 0.2 mol. Số mol của Cu = 0.2 mol -> khối lượng Cu ban đầu = 0.2 * 64 = 12.8g
Khối lượng Ag trong hh ban đầu = 45.5 - 12.8 - 13 = 19.7g.
Vì Cu và Ag là 2 kim loại đứng sau H2 trong dãy hoạt động của kim loại nên ko thể tác dụng được với dd HCl
Theo đề bài ta có : nH2 = \(\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
a) PTHH :
\(Zn+2HCl->ZnCl2+H2\uparrow\)
0,2mol.....................................0,2mol
\(2Cu+O2-^{t0}->2CuO\)
\(2Zn+O2-^{t0}->2ZnO\)
0,2mol........................0,2mol
\(Ag+O2\ne ko-p\text{ư}\)
Chất rắn thu được sau khi nung là CuO và ZnO , Ag
Gọi x,y lần lượt là số mol của Cu và Ag
Ta có :
mZnO + mCuO + mAg = 51,9
mZn + mCu + mAg = 45,5
ta có :
mCu + mAg = 45,5 - 0,2.65
<=> 64x + 108y =32,5 (1)
mCuO + mAg = 51,9 - 0,2.81
<=> 80x + 108y = 35,7 (2)
Giải (1) và (2) ta được : \(\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,182\left(mol\right)\end{matrix}\right.\)
b)
thành phần % theo khối lượng có trong hỗn hợp ban đầu là :
\(\left\{{}\begin{matrix}\%mZn=\dfrac{0,2.65}{45,5}.100\%\approx28,57\%\\\%mCu=\dfrac{0,2.64}{45,5}.100\%\approx28,13\%\\\%mAg=100\%-28,57\%-28,13\%=43,3\%\end{matrix}\right.\)
Vậy...