Cho 12,88 gam hh A gồm Fe và Mg vào 700ml dd AgNO3. Sau khi phản ứng hoàn toàn thu được chất rắn C (gồm 2 kim loại) nặng 48,72 gam và dưng dịch D. Cho dd NaOH dư vào dd D thu được kết tủa E. Lọc tách kết tủa E đem nung trong không khí đến khối lượng không đổi thu được 14 gam chất rắn.
a. Tính thành phần % về khối lượng của các chất trong A
b. Tính nồng độ mol dd AgNO3 đã dùng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trong dd ban đầu:
K+_____a mol
Mg2+___b mol
Na+____c mol
Cl-_____a + 2b + c mol
mhhbđ = 74.5a + 95b + 58.5c = 24.625 g______(1)
nAgNO3 = 0.3*1.5 = 0.45 mol
Cho Mg vào A có phản ứng (theo gt) nên Ag(+) còn dư, Cl(-) hết. Rắn C gồm Ag và có thể cả Mg còn dư nữa. Thật vậy, khi cho rắn C vào HCl loãng thì khối lượng rắn bị giảm đi, chính do Mg pư, Ag thì không. Vậy mrắn C giảm = mMg chưa pư với A = 1.92 g.
=> nMg dư = 1.92/24 = 0.08 mol
=> nMg pư với A = 2.4/24 - 0.08 = 0.02 mol________(*)
Khi cho Mg vào A có pư:
Mg + 2Ag(+) ---> 2Ag(r) + Mg(2+)
0.02__0.04
=> nAg(+) pư với dd ban đầu = 0.45 - 0.04 = 0.41 mol
Ag(+) + Cl(-) ---> AgCl(r)
0.41___0.41
Có: nCl(-) = a + 2b + c = 0.41_____________(2)
Trong các cation trên, Mg(2+) và Ag(+) có pư với OH(-), tuy nhiên trong D chỉ có Mg(2+) nên kết tủa là Mg(OH)2:
Mg(2+) + 2OH(-) ---> Mg(OH)2
Khi nung:
Mg(OH)2 ---> MgO + H2O
Ta có: nMg(2+)trongD = nMgO = 4/40 = 0.1 mol
Trong đó 0.02 mol Mg(2+) được thêm vào bằng cách cho kim loại Mg vào (theo (*)), vậy còn lại 0.08 mol Mg(2+) là thêm từ đầu, ta có:
b = 0.08 mol_________________________(3)
(1), (2), (3) => a = 0.15, b = 0.08, c = 0.1
mKCl = 74.5*0.15 = 11.175 g
mMgCl2 = 95*0.08 = 7.6 g
mNaCl = 58.5*0.1 = 5.85 g


Vì chất rắn thu được cuối cùng gồm 2 oxit kim loại nên 2 oxit này gồm MgO và Fe2O3.
Khi đó Mg và CuSO4 phản ứng hết, Fe có thể phản ứng hết hoặc dư.
Chất rắn Y gồm Cu và Fe dư
Ta có khi 1 mol Mg phản ứng tạo 1 mol Cu thì khối lượng kim loại tăng (64-24) = 40 gam.
Khi 1 mol Fe phản ứng tạo 1 mol Cu thi khối lượng kim loại tăng (64 - 56) = 8 gam.
Mà a mol Mg và b mol Fe phản ứng với CuSO4.

Vì chất rắn thu được cuối cùng gồm 2 oxit kim loại nên 2 oxit này gồm MgO và Fe2O3.
Khi đó Mg và CuSO4 phản ứng hết, Fe có thể phản ứng hết hoặc dư.
Chất rắn Y gồm Cu và Fe dư
Ta có khi 1 mol Mg phản ứng tạo 1 mol Cu thì khối lượng kim loại tăng (64-24) = 40 gam.
Khi 1 mol Fe phản ứng tạo 1 mol Cu thi khối lượng kim loại tăng (64 - 56) = 8 gam.
Mà a mol Mg và b mol Fe phản ứng với CuSO4.

Fe3O4+4CO=>3Fe+ 4CO2
CuO+CO=>Cu+CO2
Cr B gồm Fe Cu
HH khí D gồm CO dư và CO2
CO2 +Ca(OH)2=>CaCO3+H2O
p/100 mol<= p/100 mol
2CO2+Ca(OH)2 => Ca(HCO3)2
p/50 mol
Ca(HCO3)2+ 2NaOH=>CaCO3+ Na2CO3+2H2O
p/100 mol p/100 mol
Tổng nCO2=0,03p mol=nCO
=>BT klg
=>m+mCO=mCO2+mB=>mB=m+0,84p-1,32p=m-0,48p
c) hh B Fe+Cu
TH1: Fe hết Cu chưa pứ cr E gồm Ag Cu
dd Z gồm Fe(NO3)2
Fe+2Ag+ =>Fe2+ +2Ag
TH2:Cu pứ 1p cr E gồm Cu và Ag
Fe+2Ag+ => Fe2+ +2Ag
Cu+2Ag+ =>Cu2+ +2Ag
Dd Z gồm 2 muối của Fe2+ và Cu2+

Bảo toàn Cu: `n_{Cu}=n_{CuSO_4}={50.9,6\%}/{160}=0,03(mol)`
`->m_{Cu}=0,03.64=1,92<2,48`
`->Y` chứa `Fe` dư và `Cu.`
`->m_{Fe\ du}=2,48-1,92=0,56(g)`
`Mg+CuSO_4->MgSO_4+Cu`
`Fe+CuSO_4->FeSO_4+Cu`
Đặt `n_{Mg}=x(mol);n_{Fe\ pu}=y(mol)`
Theo PT: `n_{Cu}=x+y=0,03(1)`
`MgSO_4+2NaOH->Mg(OH)_2+Na_2SO_4`
`FeSO_4+2NaOH->Fe(OH)_2+Na_2SO_4`
`Mg(OH)_2` $\xrightarrow{t^o}$ `MgO+H_2O`
`4Fe(OH)_2+O_2` $\xrightarrow{t^o}$ `2Fe_2O_3+4H_2O`
Theo PT: `n_{MgO}=x(mol);n_{Fe_2O_3}=0,5y(mol)`
`->40x+160.0,5y=2(2)`
`(1)(2)->x=0,01;y=0,02`
`->m=0,01.24+0,02.56+0,56=1,92(g)`
`\%m_{Mg}={0,01.24}/{1,92}.100\%=12,5\%`
`\%m_{Fe}=100-12,5=87,5\%`
`m_{dd\ spu}=1,92+50-2,48=49,44(g)`
`Z` gồm `MgSO_4:0,01(mol);FeSO_4:0,02(mol)`
`->C\%_{MgSO_4}={0,01.120}/{49,44}.100\%\approx 2,43\%`
`C\%_{FeSO_4}={0,02.152}/{49,44}.100\%\approx 6,15\%`

Câu 2:
1. \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
2. \(Zn+CuSO_4\rightarrow ZnSO_4+Cu\)
3. \(FeO+H_2\rightarrow Fe+H_2O\)
4. \(Fe+4HNO_{3\left(loãng\right)}\rightarrow Fe\left(NO_3\right)_3+NO\uparrow+2H_2O\)

C1 :
- Hòa tan hh vào dd HCl :
Mg + 2HCl => MgCl2 + H2
Fe + 2HCl => FeCl2 + H2
X : MgCl2 , FeCl2 , HCl dư
Y : Cu
Z : H2
- Dung dịch X + NaOH :
MgCl2 + 2NaOH => Mg(OH)2 + 2NaCl
FeCl2 + 2NaOH => Fe(OH)2 + 2NaCl
Kết tủa T : Mg(OH)2 , Fe(OH)2
- Nung T :
Mg(OH)2 -to-> MgO + H2O
4Fe(OH)2 + O2 -to-> 2Fe2O3 + 4H2O
Chất rắn : MgO , Fe2O3
C2:
Đặt : nCl2 = x (mol) , nO2 = y (mol)
nA = x + y = 0.6 (mol) (1)
mCl2 + mO2 = 48.15 - 19.2 = 28.95 (g)
=> 71x + 32y = 28.95 (2)
(1),(2) :
x = 0.25 , y = 0.35
Đặt : nMg = a (mol) , nAl = b (mol)
Mg => Mg+2 + 2e
Al => Al+3 + 3e
Cl2 + 2e => 2Cl-1
O2 + 4e => 2O2-
BT e :
2a + 3b = 0.25*2 + 0.35*4 = 1.9
mB = 24a + 27b = 19.2
=> a = 0.35
b = 0.4
%Mg = 0.35*24/19.2 * 100% = 43.75%

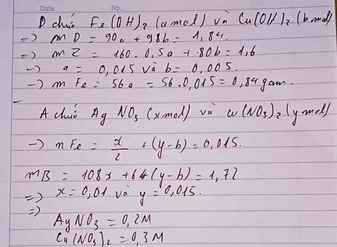

C\(\left\{{}\begin{matrix}Fedư\\Ag\end{matrix}\right.\)
PTPU
Mg+2AgNO\(_3\)->Mg\(\left(NO_3\right)_2\)+2Ag
x.............2x..............x.............2x(mol)
Fe+2AgNO\(_3\)->Fe\(\left(NO_3\right)_2\)+2Ag
a...........2a................a...........2a(mol)
\(m_{Mg}+m_{Fe}=m_{hh}\)
24x+56y=12,88g(1)
mặt khác:
\(m_{Ag}+m_{Fedư}=108\left(2x+a\right)+56\left(y-a\right)\)
<=>216x+56y+52a=48,72(2)
PTPU
Mg(NO3)2+ 2NaOH->Mg(OH)2+2NaNO3
x..................2x..................x................2x(mol)
Fe(NO3)2+2NaOH->Fe(OH)2+2NaNO3
a.....................2a............a...............2a(mol)
Mg(OH)\(_2\)->MgO+H\(_2O\)
x.....................x.......x(mol)
Fe(OH)2->FeO+H2O
x..................x...........x(mol)
4FeO+3O2->2Fe2O3
a........................0,5a(mol)
\(m_{MgO}+m_{Fe_2O_3}=m_{hh}\)
40x+80a=14g(3)
từ (1),(2),(3)=>x=0,16mol;y=0,16mol;a=0,09mol
n\(_{Mg}=0,16mol=>m_{Mg}=0,16.24=3.84g\)
%mMg=3,84.100/12,88=29,81%
%mFe=100-29,81=70,19%
\(n_{AgNO_3}=0,5mol\)
CMAgNO3=0,5/0,7=0,71M
*giải thích bài làm của mình chút nha :
vì Fe dư nên mặc dù có y mol nhưng chỉ phản ứng a mol