Nguyên tử X ;Y co phân lớp ngoài cùng lần lượt là 4px ; 4sy .Biết 2 nguyên tố X ; Y không phải là khí hiếm .Tổng số electron trên 2 phân lớp ngoài cùng của X ; y là 7 electron . Xác định số hiệu của X ; Y
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a.
- Theo đề, ta có:
\(d_{\dfrac{X}{O}}=\dfrac{M_X}{M_O}=\dfrac{M_X}{16}=4\left(đvC\right)\)
=> MX = 64(g)
Vậy X là đồng (Cu)
- Theo đề, ta có:
\(d_{\dfrac{X}{S}}=\dfrac{M_X}{M_S}=\dfrac{NTK_X}{NTK_S}=\dfrac{NTK_X}{32}=8\left(đvC\right)\)
=> NTKX = 256(đvC)
Vậy X là menđelevi (Md)
- Theo đề, ta có:
\(d_{\dfrac{X}{Na+S}}=\dfrac{M_X}{M_{Na}+M_S}=\dfrac{M_X}{55}=1\left(lần\right)\)
=> MX = 55(g)
Vậy X là mangan (Mn)
b.
\(PTK_{MgO}=24+16=40\left(đvC\right)\)
\(PTK_{H_2CO_3}=1.2+12+16.3=62\left(đvC\right)\)
\(PTK_{KOH}=39+16+1=56\left(đvC\right)\)
\(PTK_{Ba\left(NO_3\right)_2}=137+\left(14+16.3\right).2=261\left(đvC\right)\)
\(PTK_{\left(NH_4\right)_2SO_4}=\left(14+1.4\right).2+32+16.4=132\left(đvC\right)\)

a)Nguyên tử A là nguyên tố B(Bo) nặng 10
Nguyên tử B là nguyên tố Ne(Neon) nặng 20
Nguyên tử X là nguyên tố N(Nito)nặng 14
Cách tính ta tìm nguyên tử X trc ta lấy NTK của Oxi nhân với 2,5=14(ng tử N,lấy ng tửX nhân 1,4=20(ng tử Ne),ta lấy ng tử B tìm được chia cho 2ta đc nguyên tử Bo=10
b)So sánh nặng nhẹ :Nguyên tử B nhẹ hơn nguyên tử N =10/14=5/7 lần
Nguyên tử N nặng hơn nguyên tử B=14/10=7/5=1,4 lần
c)Khối lượng 1 g của ng tử A là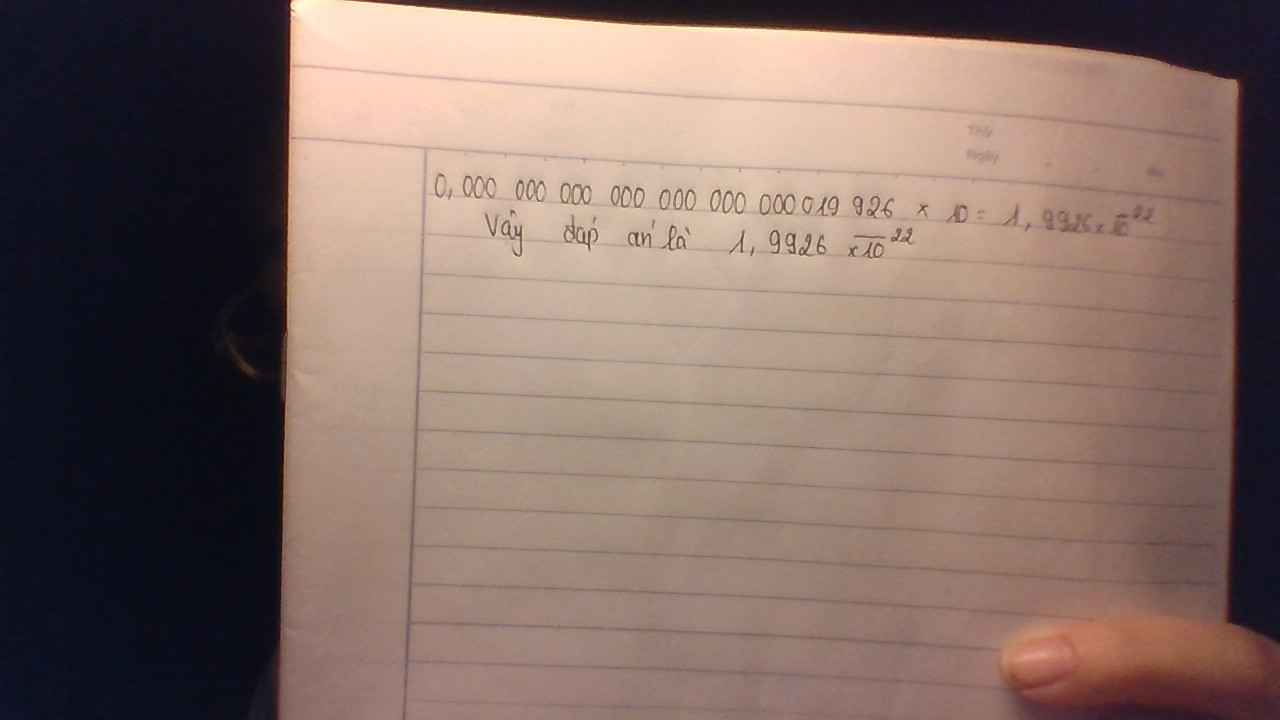
Phần cuối thì mk ko bt lm vì nó dài quá nó cg khá dễ mk chắc bn có thể lm đc

a)
$2X = 5.16 \Rightarrow X = 40$
Vậy X là nguyên tố Canxi
b)
$m_{Ca} = 40.1,66.10^{-24} = 66,4.10^{-24}(gam)$
c)
$m_{5O} = 5.16.1,66.10^{-24} = 132,8.10^{-24}(gam)$
d)
$\dfrac{M_{Ca}}{M_O} = \dfrac{40}{16} = 2,5$
(nặng gấp 2,5 lần nguyên tử oxi)
$\dfrac{M_{Ca}}{M_{Cu}} = \dfrac{40}{64} = 0,625$
(nhẹ gấp 0,625 lần ngyen tử Cu)
2/
a) \(2M_X=5M_O\)
=> \(M_X=\dfrac{5.16}{2}=40\)
Vậy X là nguyên tố Canxi (Ca)
b) \(m_{Ca}=40.1,66.10^{-24}=6,64.10^{-23}\left(g\right)\)
c) \(m_O=5.16.1,66.10^{-24}=1,328.10^{-22}\left(g\right)\)
d) Nguyên tử X nặng hơn nguyên tử Oxi và nặng hơn \(\dfrac{40}{16}=2,5\left(lần\right)\)
Nguyên tử X nhẹ hơn nguyên tử Đồng và nhẹ hơn \(\dfrac{40}{64}=0,625\left(lần\right)\)

a) Nguyên tử của Oxi là 16
=> nguyên tử X= 16.2=32
=> nguyên tử X là nguyên tử Lưu Huỳnh
b) nguyên tử của Cacbon là 12
=> Nguyên tử X = 12:0,5=24
=> Nguyên tử X là nguyên tử Magie

1.
a) NTK của O = 16
=> PTK của hợp chất = 16
Lại có phân tử gồm 1 nguyên tử x và 4 nguyên tử H
=> PTK của hợp chất = 1x + 4H = 16
<=> x + 4.1 = 16
<=> x + 4 = 16
<=> x = 12
=> x là Cacbon ( C )
b) Phần trăm theo khối lượng của nguyên tố x trong hợp chất = \(\frac{12}{16}\cdot100=75\%\)
2.
Phân tử của hợp chất gồm 2 nguyên tử nguyên tố x liên kết với 1 nguyên tố O
Lại có PTK của hợp chất = 62
=> PTK của hợp chất = 2x + 1O = 62
<=> 2x + 1.16 = 62
<=> 2x + 16 = 62
<=> 2x = 46
<=> x = 23
=> x là Natri ( Na )
-Cấu hình e của X: 1s22s22p63s23p64s23d104px
- Cấu hình e của Y: 1s22s22p63s23p64sy
- Tổng số e trên 2 phân lớp ngoài cùng x+y=7
- Có 2 trường hợp:
+ y=1 \(\rightarrow\) x=6\(\rightarrow\)X:1s22s22p63s23p64s23d104p6 có 8e ở lớp thứ 4 là khí hiếm(loại)
+ y=2\(\rightarrow\)x=5\(\rightarrow\)X:1s22s22p63s23p64s23d104p5(có 7e ở lớp thứ 4 nên không phải khí hiếm. Vậy ZX=35)
Y: 1s22s22p63s23p64s2(ZY=20)