Tại sao có trường hợp NaOH tác dụng với khí SO2 lại tạo ra 2 muối là Na2SO3 và NaHSO3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Vì có phản ứng NaOH + NaHSO3 → Na2SO3 + H2O
nếu NaOH chưa hết thì luôn sinh ra Na2SO3 nên luôn tạo muối trung hòa trước.
Khi SO2 dư thì xảy ra pứ Na2SO3 + SO2 + H2O → 2NaHSO3 tạo muối axit.
Trong bài toán sục khí SO2 vào dd kiềm thì tính axit trong dung dịch sẽ tăng dần theo thời gian và chỉ khi nào trong dung dịch , tính axit nhiều hơn tính bazo thì nó mới tạo muối axit . Ban đầu thì lượng axit được sục vào là chưa đáng kể nên tính bazo sẽ lấn át tính axit , do đó chỉ tạo toàn muối trung hoà . Muối trung hoà sẽ tiếp tục được tạo ra cho tới khi bazo = axit thì lúc đó , 100% dung dịch chỉ bao gồm muối trung hoà . Nhưng ta lại tiếp tục sục thêm SO2 vào , làm tăng tính axit cho dung dịch muối . Lúc này , tính axit bắt đầu chiếm ưu thế trong dung dịch , kết quả là tạo ra muối axit .
P/s : Nói nôm na là vậy á , mình đã cố gắng giải thích dễ hiểu nhất có thể rồi đó ạ :v

\(a) n_{SO_2} = \dfrac{3,36}{22,4} = 0,15(mol) ; n_{NaOH} = 0,15.2 = 0,3(mol)\\ \dfrac{n_{NaOH}}{n_{SO_2}} = \dfrac{0,3}{0,15} = 2\)
Suy ra muối tạo thành là Na2SO3
\(b) n_{SO_2}= \dfrac{6,4}{32} = 0,2(mol) ; n_{NaOH} = 0,05.1 = 0,05(mol)\\ \dfrac{n_{NaOH}}{n_{SO_2}} = \dfrac{0,05}{0,2} = 0,25 <1\)
Suy ra muối tạo thành là NaHSO3
\(c) n_{SO_2} = \dfrac{4,48}{22,4} = 0,2(mol) ; n_{NaOH} = 0,1(mol)\\ \dfrac{n_{NaOH}}{n_{SO_2} }=\dfrac{0,1}{0,2} = 0,5 <1\)
Suy ra muối tạo thành là Na2SO3
a) Ta có: \(\left\{{}\begin{matrix}n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\n_{NaOH}=2\cdot0,15=0,3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Tạo muối trung hòa
PTHH: \(2NaOH+SO_2\rightarrow Na_2SO_3+H_2O\)
Các phần còn lại thì tương tự, bạn dựa vào hình dưới để làm nhé !
*P/s: Thay CO2 bằng SO2

Đáp án D
X là: CH2NH2COOH
CH2NH2COOH + HCl → CH2NH3ClCOOH
+ Na2O → CH2NH2COONa + H2O
Y là: CH3CH2NO2:
CH3CH2NO2 + [H] → CH3CH2NH2 (Y1)
CH3CH2NH2 + H2SO4 → CH3CH2NH3HSO4 (Y2)
CH3CH2NH3HSO4 + 2NaOH → CH3CH2NH2 + Na2SO4 + H2O
Z là CH3COONH4: CH3COONH4 + NaOH → CH3COONa + NH3 + H2O

a) PTHH: SO2 + 2 NaOH -> Na2SO3 + H2O
b) Vì p.ứ chỉ tạo sp là muối Na2SO3 và H2O
=> nNaOH= 2.nSO2= 2. (3,36/22,4)= 0,3(mol)
=> mNaOH= 0,3.40=12(g)
=>C%ddNaOH= (12/300).100=4%
c) mddNa2SO3= mSO2 + mddNaOH= 0,15. 64+300= 309,6(g)
nNa2SO3=nSO2= 0,15(mol) => mNa2SO3= 0,15.126=18,9(g)
C%ddNa2SO3= (18,9/309,6).100=6,105%
Số mol của khí lưu huỳnh đioxit
nSO2 = \(\dfrac{V_{SO2}}{22,4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
a) Pt : SO2 + 2NaOH → Na2SO3 + H2O\(|\)
1 2 1 1
0,15 0,3 0,15
b) Số mol của natri hidroxit
nNaOH= \(\dfrac{0,15.2}{1}=0,3\left(mol\right)\)
Khối lượng của natri hidroxit
mNaOH = nNaOH . MNaOH
= 0,3 . 40
= 12 (g)
Nồng độ phần trăm của dung dịch natri hidroxit
C0/0NaOH = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{12.100}{300}=4\)0/0
c) Số mol của muối natri sunfit
nNa2SO3 = \(\dfrac{0,3.1}{2}=0,15\left(mol\right)\)
Khối lượng của muối natri sunfit
mNa2SO3 = nNa2SO3 . MNa2SO3
= 0,15 . 126
= 18,9 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mSO2 + mNaOH
= (0,15 . 64) + 300
= 309,6 (g)
Nồng độ phần trăm của muối natri sunfit
C0/0Na2SO3 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{18,9.100}{309,6}=6,1\)0/0
Chúc bạn học tốt

\(n_{SO_2}=\dfrac{8.96}{22.4}=0.4\left(mol\right)\)
\(n_{NaOH}=0.5\cdot1.2=0.6\left(mol\right)\)
\(\dfrac{n_{NaOH}}{n_{SO_2}}=\dfrac{0.6}{0.4}=1.5\)
\(n_{Na_2SO_3}=a\left(mol\right),n_{NaHSO_3}=b\left(mol\right)\)
\(\left\{{}\begin{matrix}2a+b=0.6\\a+b=0.4\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}a=0.2\\b=0.2\end{matrix}\right.\)
\(C_{M_{Na_2SO_3}}=C_{M_{NaHSO_3}}=\dfrac{0.2}{0.5}=0.4\left(M\right)\)
\(\Rightarrow A\)
- Gọi số mol Na2SO3 và NaHSO3 tạo ra là a, b mol .
BTS : a + b = nSO2 = 0,4
BTĐT : 2a + b = 0,6 .
=> a = b = 0,2 mol
=> CM của Na2SO3 và NaHSO3 lần lượt là : 0,4M và 0,4M
Vậy ....

nNaOH=0.01(mol)
2NaOH+SO2->Na2SO3+H2O
0.01 0.005
V=0.112(l)
2)nHCl=0.5(mol)
MgO+2HCl->MgCl2+H2O
x 2x
Fe2O3+6HCl->2FeCl3+3H2O
y 6y
Theo bài ra:40x+160y=12
2x+6y=0.5
x=0.1(mol) mMgO=4(g)
y=0.05(mol) mFe2O3=8(g)
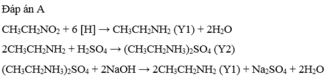
Ta có nếu SO2 phản ứng hết thì có PT:
PTHH: SO2 + 2NaOH -> Na2SO3 + H2O
Nhưng nếu SO2 dư sẽ có phản ứng sau:
SO2 + Na2SO3 + H2O -> 2NaHSO3
Giải thích cho cơ sở này như sau:
Khi lên cấp 3, khi học về ion ta sẽ thấy:
Muối Na2SO3 sẽ được cấu tạo từ ion Na+ và ion SO3-
Lại có: Bazơ NaOH là 1 bazơ mạnh => ion Na+ có tính của bazơ mạnh
Axit H2SO3 là 1 axit rất yếu => ion SO3- có tính của axit yếu
=> Muối Na2SO3 có tính bazơ
Hỗn hợp SO2 + H2O chính là H2SO3 bị phân hủy thành nên hỗn hợp SO2 + H2O mang tính axit
axit luôn có thể tác dụng với bazơ nên có xảy ra phản ứng
SO2 + H2O + Na2SO3 -> 2NaHSO3